“节能减排”,减少全球温室气体排放,意义十分重大.二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用NaOH溶液喷淋“捕捉”空气中的CO
2.

(1)使用过量NaOH溶液吸收CO
2,反应的离子方程式为
;若含有3molNaOH的溶液“捕捉”了22.4LCO
2气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为
(用离子浓度的关系式表示).
(2)①以CO
2和NH
3为原料可合成化肥尿素[CO(NH
2)
2].
已知:2NH
3(g)+CO
2(g)═NH
2CO
2NH
4(s)△H=-159.47kJ?mol
-1NH
2CO
2NH
4(s)═CO(NH
2)
2(S)+H
2O(g)△H=+72.49kJ?mol
-1H
2O(1)═H
2O(g)△H=+44.0kJ?mol
-1试写出NH
3和CO
2合成尿素和液态水的热化学方程式
.
②CO
2通过反应可转化为CO,在催化剂作用下CO和H
2反应生成甲醇:CO(g)+2H
2(g)?CH
3OH(g),某容积可变的密闭容器中充有10molCO与20molH
2,CO的平衡转化率(a)与温度、压强的关系如图所示.
a.若A点表示在某时刻达到的平衡状态,此时容器的容积为VL,则该温度下的平衡常数K=
;
平衡状态B点时容器的容积V
B
VL.(填“大于”、“小于”或“等于”)
b.若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间t
A
t
C(填“>”、“<”或“=”)
c.在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是
(写出一种即可).




 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案

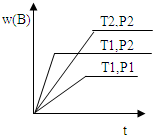 已知某反应aA(g)+bB(g)?cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )
已知某反应aA(g)+bB(g)?cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )