
| A. | 0.03mol/L | B. | 0.3mol/L | C. | 0.015mol | D. | 0.25 mol |
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Na2CO3 |
| Z | Cl2 | Fe | NaOH溶液 | HCl溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加到稀硝酸中 | |
| B. | 向稀盐酸中滴入Na2CO3溶液 | |
| C. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 | |
| D. | 将CO2通入一定量的NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g 重水(D2O)中含有的中子数为NA | |
| B. | 常温常压下,22.4 L O2 含有的分子数为NA | |
| C. | 1 L 1 mol/L FeCl3溶液中含有Fe3+的数目为NA | |
| D. | 0.1 mol CO2分子中含有的共用电子对的数目是0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | |
| B. | v正(X)=v逆(Z) | |
| C. | 容器内X、Y、Z的浓度之比为l:2:2 | |
| D. | 单位时间内消耗0.1 mol X的同时生成0.2 mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 | |
| B. | Zn2+核外电子排布式为1s22s22p63s23p63d10 | |
| C. | 基态铜原子的外围电子排布图: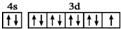 | |
| D. | 基态碳原子的最外层电子排布图: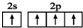 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含共价键的物质一定是共价化合物 | |
| B. | HF、HCl、HBr、HI沸点逐渐增加是因为分子量逐渐增加 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 金属与非金属之间形成的是离子键,非金属之间则形成的是共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com