
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态 Cl原子核外电子排布式为__________________________,P、S、Cl的第一电离能由大到小顺序为____________________,P、S、Cl的电负性由大到小顺序为_______________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子构型为__________。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为_______;以“—”表示σ键、“→”表示配位键,写出CO分子的结构式__________。
(4)已知MgO与NiO的晶体结构(如图1)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO_____NiO(填“>”、“<”或“=”),理由是_______________________________。
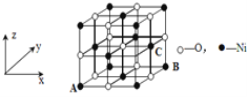
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______。
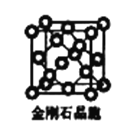
(6)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(请用r和a表示不要求计算结果)。
【答案】1s22s22p63s23p5 Cl> P > S Cl> S > P sp3 V形 8 ![]() > Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (1,
> Mg2+半径比Ni2+小,MgO的晶格能比NiO大 (1,![]() ,
,![]() ) 8
) 8 ![]()
![]()
【解析】
(1)Cl为17号元素,结合核外电子的排布规律书写基态 Cl原子的电子排布式;同周期随原子序数增大,元素第一电离能呈增大趋势,半满稳定状态,能量较低,第一电离能高于同周期相邻元素;元素的非金属性越强,电负性数值越大;
(2)根据价层电子对个数=σ键个数+孤电子对个数计算SCl2中S原子杂化轨道数分析解答;
(3)CO分子中C与O之间形成三键,其中有一个为配位键,CO与中心原子间形成4个配位键,据此解答;
(4)Mg2+半径比Ni2+小,结合晶格能的大小分析判断;
(5)根据图示,C离子的x系坐标与B的x系坐标相同,y、z系坐标都在中点上;
(6)金刚石晶胞中有4个碳原子位于晶胞内部,每个顶点每个面心上各有1个原子;碳原子与周围相接触的4个碳原子形成正四面体,顶点碳原子与正四面体中心碳原子连线处于晶胞体对角线上,二者距离等于晶胞体对角线长度的![]() ,据此计算r,从而计算该晶胞中所有C原子的体积和晶胞体积,结合原子空间利用率=
,据此计算r,从而计算该晶胞中所有C原子的体积和晶胞体积,结合原子空间利用率=![]() 分析计算。
分析计算。
(1)Cl为17号元素,基态 Cl原子的电子排布为1s22s22p63s23p5;同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:Cl>P>S;元素的非金属性越强,电负性数值越大,P、S、Cl的电负性由大到小顺序为Cl> S > P,故答案为:1s22s22p63s23p5;Cl>P>S;Cl> S > P;
(2)SCl2中S原子杂化轨道数为2+![]() (6-2)=4,采取sp3杂化,含有两对孤电子对,所以该分子构型为V形,故答案为:sp3;V形;
(6-2)=4,采取sp3杂化,含有两对孤电子对,所以该分子构型为V形,故答案为:sp3;V形;
(3)Ni与CO能形成配合物Ni(CO)4,1个CO中含有1个配位键,CO与中心原子间形成4个配位键,因此一个Ni(CO)4分子中8个配位键;CO分子中C与O之间形成三键,其中有一个为配位键,CO分子的结构式为![]() ,故答案为:8;
,故答案为:8;![]() ;
;
(4)Mg2+半径比Ni2+小,所以氧化镁的晶格能大于氧化镍,则熔点:MgO>NiO,故答案为:>;Mg2+半径比Ni2+小,MgO的晶格能比NiO大;
(5)NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),而C离子的x系坐标与B的x系坐标相同,y、z系坐标都在中点上,所以C离子坐标参数为(1,![]() ,
,![]() ),故答案为:(1,
),故答案为:(1,![]() ,
,![]() );
);
(6)金刚石晶胞中有4个碳原子位于晶胞内部,每个顶点每个面心上各有1个原子,该晶胞中C原子个数=8×![]() +6×
+6×![]() +4=8;碳原子与周围相接触的4个碳原子形成正四面体,顶点碳原子与正四面体中心碳原子连线处于晶胞体对角线上,且二者距离等于晶胞体对角线长度的
+4=8;碳原子与周围相接触的4个碳原子形成正四面体,顶点碳原子与正四面体中心碳原子连线处于晶胞体对角线上,且二者距离等于晶胞体对角线长度的![]() ,晶胞体对角线长度等于晶胞边长的
,晶胞体对角线长度等于晶胞边长的![]() 倍,则2r=
倍,则2r=![]() a,则r=
a,则r=![]() a;该晶胞中所有C原子体积=8×
a;该晶胞中所有C原子体积=8×![]() πr3、晶胞体积=a3,原子空间利用率=
πr3、晶胞体积=a3,原子空间利用率=![]() =
=![]() =
=![]() =
=![]() π,故答案为:8;
π,故答案为:8;![]() ;
;![]() π。
π。


科目:高中化学 来源: 题型:
【题目】化合物Z是一种医药中间体,由X制备Z的物质转化路线如图,下列说法正确的是( )
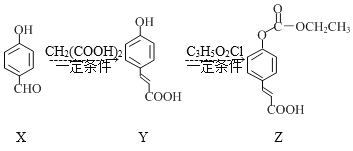
A.X在空气中不易氧化变质
B.可用FeCl3溶液鉴别X、Y
C.1molX最多能与4molH2反应
D.C3H5O2Cl的结构简式为ClCOOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。(室温下,H2CO3的Ka1=4.3×10﹣7;Ka2=5.6×10﹣11)
(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。写出电极A发生的电极反应式___。
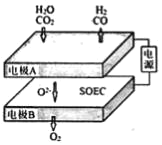
(二)CO2的综合利用
(1)CO2与CH4经催化重整制得合成气:
反应Ⅰ.CH4(g)H+CO2(g)2CO(g)+2H2(g)△H1
已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示
物质 | H2(g) | CO(g) | CH4(g) |
标准燃烧热△H/kJmol﹣1 | ﹣285.8 | ﹣283.0 | ﹣890.3 |
则反应I的△H=___kJmol﹣1。
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),在10L恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。
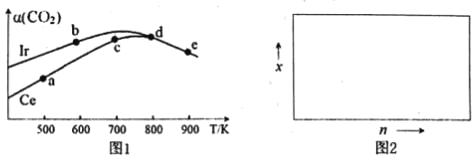
①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0
B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是Ce
C.状态d时,v(正)<v(逆)
D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.9克的镁铝合金,投入到500mL 2mol/L的盐酸中,金属完全溶解,再加入4mol/L的氢氧化钠溶液,若要生成沉淀最多,加入这种氢氧化钠溶液的体积是()
A.125mL B.200mL C.250mL D.560mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
A.生成40.0L N2(标准状况)B.有0.250mol KNO3被氧化
C.转移电子的物质的量为1.25molD.被氧化的N原子的物质的量为4.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,完全正确的一组是
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过![]() 容积的试管加热
容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤加热坩埚要垫上石棉网
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管竖直伸入试管内滴加液体
⑨稀释浓硫酸时,应沿器壁缓缓地将水加入浓硫酸中
⑩用镊子从煤油中取出金属钠,再用小刀切一小块,然后将剩下的钠放回原瓶
A.①④⑦⑩B.①④⑤⑦⑩C.①④⑤⑦⑧⑩D.④⑤⑦⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
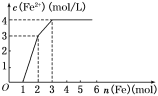
【题目】某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示,则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为____,按反应的先后顺序写出该过程的离子反应方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 相对分子质量为72的某烷烃,一氯代物有8种
B. 聚合物![]() 可由单体CH2=CHCH3CH=CH2加聚制得
可由单体CH2=CHCH3CH=CH2加聚制得
C. CH3CH(OH)CH(CH3)2的名称为2-甲基-3-丁醇
D. 植物油氢化、塑料和橡胶的老化过程中均发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸 发生酯化反应的产物。
发生酯化反应的产物。
(1)甲一定含有的官能团的名称是________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是____________________________。
(3)菠萝酯的结构简式是____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com