
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A、1mol西瓜 |
| B、摩尔是7个基本物理量之一 |
| C、常温常压下,22.4L氧气的物质的量为1mol |
| D、Na的摩尔质量为23g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 )发生类似反应①的反应,得到一种环状化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为
)发生类似反应①的反应,得到一种环状化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为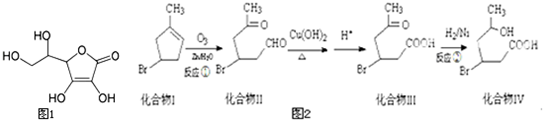
查看答案和解析>>
科目:高中化学 来源: 题型:
 二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应.
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体,化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNaOH的摩尔质量为40g |
| B、NH4HCO3的相对分子质量为79g |
| C、64gSO2中含有1molO2 |
| D、0.5molCO2约含有3.01×1023个CO2分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com