
【题目】下图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol e一,若不考虑溶液体积的变化,则下列叙述正确的是( )
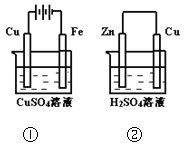
A. 在①中Cu棒为阳极;在②中Cu棒为负极
B. 电极上生成物质的质量:①<②
C. 电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;②中负极:2H+ + 2e一= H2↑
D. 溶液的pH:①不变;②增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于氧化钠和过氧化钠的叙述中不正确的是
A.Na2O2是淡黄色固体,Na2O是白色固体,阴阳离子个数比均为1:2
B.Na2O2和Na2O均为碱性氧化物,都能与水反应生成NaOH
C.Na2O和Na2O2均能与CO2发生反应,都有Na2CO3生成
D.2gH2充分燃烧后产物被Na2O2完全吸收,Na2O2固体增重2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2(g)+O2(g) ![]() 2SO3(g),ΔH<0已达平衡,在其他条件不变的情况下,如果分别改变下列条件,对化学反应速率和化学平衡产生影响与图像不相符的是
2SO3(g),ΔH<0已达平衡,在其他条件不变的情况下,如果分别改变下列条件,对化学反应速率和化学平衡产生影响与图像不相符的是
A. 增加氧气浓度 B. 增大压强
B. 增大压强 C. 升高温度
C. 升高温度 D. 加入催化剂
D. 加入催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒(V2O5,摩尔质量为182g·mol-1)可作化学工业中的催化剂,广泛用于冶金、化工等行业。V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性,属于两性氧化物。某研究小组将从某粗钒(主要含有V2O5,还有少量Al2O3、Fe2O3)中提取V2O5。实验方案设计如下:

已知:NH4VO3是白色粉末,微溶于冷水,可溶于热水,不溶于乙醇、醚。
2NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
请回答:
(1)第①步操作的实验装置如右图所示,虚线框中最为合适的仪器是________。(填编号)
![]()
![]()
![]()
![]()

(2)调节pH为8~8.5的目的________。
(3)第④步洗涤操作时,可选用的洗涤剂_________。(填编号)
A.冷水 B.热水 C.乙醇 D.1%NH4Cl溶液
(4)第⑤步操作时,需在流动空气中灼烧的可能原因________。
(5)硫酸工业中,SO2转化为SO3的催化剂就选用V2O5,催化过程经两步完成,将其补充完整:________(用化学方程式表示),4VO2+O2=2V2O5。
(6)将0.253g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中含有V3+,滴加指示剂,用0.250mol·L-1Na2S2O3溶液滴定,达到终点消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为________。(已知:I2+2Na2S2O3=Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某反应在体积为4 L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。

(1)该反应的化学方程式为____________________
(2)反应开始至2分钟时,B的平均反应速率为__________,A的转化率为________________________
(3)能说明该反应已达到平衡状态的是______________
a.容器内气体的颜色保持不变
b.容器内混合气体的密度保持不变
c.v逆(B)= 2v正(C)
d.容器内混合气体的平均相对分子质量不再改变
II.如图是氢氧燃料电池构造示意图。
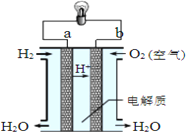
该电池工作时,电子的流向______→_____(填“a”“b”),每生成1 mol H2O则理论上电路中通过的电子数为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.电解精炼铜时,若转移2NA个电子,则阳极减少的质量为64g
B.合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
C.![]() 在常温下能自发进行,则该反应的△H>0
在常温下能自发进行,则该反应的△H>0
D.常温下,![]() 。欲使溶液中
。欲使溶液中![]() ,需调节溶液的
,需调节溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体使气囊鼓起。
已知:![]() 。
。
实验室利用如图装置模拟工业级NaN3制备。

实验Ⅰ:制备NaN3
(1)装置C中盛放的药品为____________,装置B的主要作用是__________________。
(2)为了使a容器均匀受热,装置D中进行油浴而不用水浴的主要原因是______________。
(3)氨气与熔化的钠反应生成NaNH2的化学方程式____________________________________。
(4)N2O可由NH4NO3(熔点169.6℃)在240℃分解制得,应选择的气体发生装置是________。

实验Ⅱ:分离提纯
分离提纯反应完全结束后,取出装置D中的混合物进行以下操作,得到NaN3固体。

(5)已知:NaNH2能与水反应生成NaOH和氨气,操作Ⅳ采用__________洗涤,其原因是_____________。
实验Ⅲ:定量测定
实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500.00mL溶液。
②取50.00mL溶液于锥形瓶中,加入50.00mL 0.1010![]() (NH4)2Ce(NO3)6 溶液。
(NH4)2Ce(NO3)6 溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示液,0.0500![]() (NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗标准溶液的体积为29.00mL。测定过程中涉及的反应方程式如下:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑,Ce4++Fe2+=Ce3++Fe3+
(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗标准溶液的体积为29.00mL。测定过程中涉及的反应方程式如下:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑,Ce4++Fe2+=Ce3++Fe3+
(6)配制叠氮化钠溶液时,除烧杯、玻璃棒、量筒外,还需要用到的玻璃仪器有___________。若其它读数正确,滴定到终点后读取滴定管中(NH4)2Fe(SO4)2标准溶液体积时俯视,将导致所测定样品中叠氮化钠质量分数__________(选填“偏大”、“偏小”或“不变”)。
(7)试样中NaN3的质量分数为___________。(保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是

A. 甲装置:可用来证明硫的非金属性比硅强
B. 乙装置:橡皮管的作用是能使水顺利流下
C. 丙装置:用图示的方法能检查此装置的气密性
D. 丁装置:可在瓶中先装入某种液体收集NO气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. PE(聚乙烯)材料因其无毒且易降解,广泛用于食品包装
B. “投泥泼水愈光明”中蕴含的化学反应是炭与灼热水蒸气反应得到两种可燃性气体
C. “一带一路”被誉为现代“丝绸之路”。丝绸来自合成纤维,主要含C、H、O、N元素
D. “以火烧之,紫青烟起,乃真硝石也”,古人鉴别硝石(KNO3)与朴硝(NaNO3)的方法利用了二者化学性质不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com