
在一定条件下,C(s)+H2O(g)  CO(g)+H2(g) △H>0在一容积固定的密闭容器中放入足量的焦炭与一定量的水蒸气进行反应,下列有关图像正确的是
CO(g)+H2(g) △H>0在一容积固定的密闭容器中放入足量的焦炭与一定量的水蒸气进行反应,下列有关图像正确的是
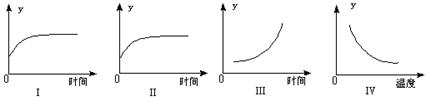
A.Ⅰ图表示反应进行过程中气体平均相对分子质量的变化
B.Ⅱ图表示反应进行过程中气体密度的变化
C.Ⅲ图表示反应达到平衡后,移去一些焦炭后水蒸气的百分含量的变化(忽略表面积的影响)
D.Ⅳ图表示反应达到平衡后,升高温度CO的百分含量的变化
科目:高中化学 来源: 题型:
无机化合物可根据其组成和性质进行分类:
(1)右图所示的物质分类方法名称是______________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
| 物质 | ||||
| 类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | HCl ______ | ③________ ④Ba(OH)2 | ⑤Na2CO3⑥______ | ⑦CO2 ⑧Na2O2 |
(3)写出⑦转化为⑤的化学方程式__________________________________________
________________________________________________________________________。
(4)呼吸面具中用⑧作为O2来源的反应原理为:______________________________
________________________________________________________________________。
(5)实验室制备⑦常用________和________反应,检验该气体的方法是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式的书写及评价均合理的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将2 mol Cl2通入到含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
| B | Mg(HCO3)2溶液与足量的NaOH溶液反应:Mg2++HCO | 正确;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-===HClO+HSO | 正确; 说明酸性: H2SO3强于HClO |
| D | 1 mol/L NaAlO2溶液和2.5 mol/L HCl溶液等体积均匀混合:2AlO | 正确;AlO |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列乙醇的化学性质不是由羟基所决定的是( )
A.跟金属钠反应
B.在足量氧气中完全燃烧生成CO2和H2O
C.在浓H2SO4存在时发生消去反应,生成乙烯
D.当银或铜存在时跟O2发生反应,生成乙醛和水
查看答案和解析>>
科目:高中化学 来源: 题型:
M、N为短周期的两种元素,M元素原子的最外层电子数≤4,N元素原子的最外层电子数>4,下列对其中说法正确的是
A.M、N可能为金属
B.若M、N为同周期元素,则原子半径M<N
C.M、N元素的单质可能与水发生置换反应
D.M、N形成的离子化合物不能体现强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在20 mL 0.1mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示。下列说法不正确的是
A.0.1 mol/L Na2CO3溶液中
c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
B.在A点:c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
C.常温下CO2饱和溶液的pH约为5.6
D.0.05 mol/L NaHCO3溶液的pH=8
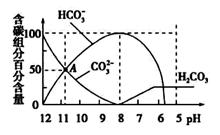
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g)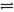 CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。
①已知:CH4(g)+3/2O2(g)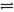 CO(g)+2H2O(g) △H1
CO(g)+2H2O(g) △H1
H2(g)+1/2O2(g) H2O(g) △H2
H2O(g) △H2
 则CH4(g)+H2O(g)
则CH4(g)+H2O(g) CO(g)+3H2(g)的△H=_____(用含△H1、△H2的式子表示)
CO(g)+3H2(g)的△H=_____(用含△H1、△H2的式子表示)
②一定条件下反应CH4(g)+H2O(g)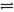 CO+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1,则上述反应的△H________0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA________KB。
CO+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1,则上述反应的△H________0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA________KB。
③维持温度T2,将0.04mol CH4(g)和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=___________,下列现象能说明该反应已经达到平衡状态的是___________(填写序号)

④在上述B点平衡基础上,向容器中再通入a mol CH4和a mol H2O气体,使之在C点重新达平衡,此时测得CO有0.03 mol,则a=______________。
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+1/2O2(g)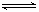 CO2(g)降低其浓度。
CO2(g)降低其浓度。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
| 容器编号 | c(CO)/mol·L-1 | c(O2)/mol·L-1 | c(CO2)/mol·L-1 | v (正)和v (逆)比较 |
| I | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v (正)= v (逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v (正)_____v (逆) |
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol/L和1.0×10-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol/L,则最终尾气中CO的浓度为________________mol/L(请保留两位有效数字)。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为____________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
与金属铝反应只能放出氢气,且能大量共存的离子组是( )
A.NH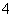 、NO
、NO 、CO
、CO 、Na+
、Na+
B.Na+、H+、Cl-、SO
C.NO 、K+、Cl-、OH-
、K+、Cl-、OH-
D.AlO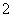 、K+、OH-、Al3+
、K+、OH-、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| 物质 组别 | 甲 | 乙 | 丙 |
| A | Al | HCl | NaOH |
| B | NH3 | O2 | HNO3 |
| C | SiO2 | NaOH | HF |
| D | SO2 | Ca(OH)2 | NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com