
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 苯 |
分析 各选项中都是烃类物质,先分别计算出C原子数为1的各物质的最简式,最简式中氢原子数越少,则其含碳量越高,据此进行解答.
解答 解:A.甲烷的分子式为CH4,最简式为也是CH4;
B.乙烷的分子式为C2H6,最简式为CH3;
C.乙烯的分子式为C2H4,最简式为CH2,
D.苯的分子式为C6H6,最简式为CH;
由于都是烃类物质,最简式中含有H原子数目越少,则其含碳量越高,所以含碳量最高的为苯,含碳量最低的是甲烷,
故选A.
点评 本题考查了元素质量分数的计算,题目难度不大,明确烃类物质的组成特点为解答关键,注意掌握质量分数的概念及表达式,试题侧重基础知识的考查,培养了学生的化学计算能力.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 胶体和溶液的本质区别是分散质粒子直径的大小 | |
| B. | 电解质与非电解质的本质区别,是在水溶液或熔融状态下中能否电离 | |
| C. | 科学家波尔首先提出原子核外的电子是在一定轨道上运动 | |
| D. | 具有相同质子数的微粒,一定属于同一种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中只能含离子键 | B. | 共价化合物中可能含离子键 | ||
| C. | 共价键只存在于共价化合物中 | D. | 离子键只存在于离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和晶体硫熔融 | B. | 石墨和食盐熔化 | ||
| C. | 晶体碘和干冰的升华 | D. | 金属钠和硝酸钠的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于16% | B. | 小于16% | C. | 大于16% | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M、N、Q三种物质的浓度一定相等 | B. | M、N全部变成了Q | ||
| C. | M、N、Q三种物质的浓度不再变化 | D. | 反应已经停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .所有铵盐都溶于水 | |
| B. | 铵态氮肥与草木灰混合使用肥效更好 | |
| C. | .铵盐受热分解都会产生氨气 | |
| D. | .铵盐都能与碱反应,都不能与酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
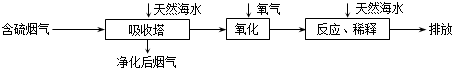
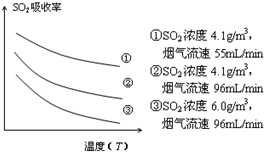
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
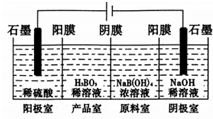
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com