
现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 _________(填“增大”“减小”或“不变”)。
_________(填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式____________________;所得溶液的pH___ 7(填“<”“>”或“=”),用离子方程式表示其原因_________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH )=a mol/L,则c(SO
)=a mol/L,则c(SO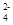 )=__________。
)=__________。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是___ _______。
(10分)(1)减小
(2)NH3·H2O+H+===NH+H2O <
NH+H2O NH3·H2O+H+
NH3·H2O+H+
(3) mol/L (4)c(NH)>c(SO)>c(H+)>c(OH-)
【解析】
试题分析:(1)由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,抑制氨水电离,导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,所以此时溶液中 减小。
减小。
(2)硫酸和氨水反应生成硫酸铵和水,离子反应方程式为NH3·H2O+H+=NH4++H2O,硫酸铵是强酸弱碱盐水解而使其溶液呈酸性,水解方程式为:NH4++H2O NH3.H2O+H+。
NH3.H2O+H+。
(3)溶液呈中性,则溶液中c(H+)=c(OH-)。溶液呈电中性,即溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO42- )+c(OH-),所以c(SO42- )=0.5c(NH4+)=0.5amol/l。(4)pH=1的硫酸溶液,c(H+)=0.1mol?L-1,氢离子浓度与氨水浓度相等,体积相同,所以恰好反应生成盐,如果NH4+不水解,c( NH4+):c(SO42-)=2:1,但水解是较弱的,所以c(NH4+)>c(SO42- );溶液呈酸性,所以c(H+)>c(OH-),故溶液中离子浓度大小顺序是c(NH4+)>c(SO42- )>c(H+)>c(OH-)。
考点:考查弱电解质的电离、盐类的水、离子浓度大小的比较
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。该题的关键是利用好电荷守恒、物料守恒、质子守恒等关系式,有利于培养学生的逻辑推理能力和创新思维能力。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
(8分)现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵⑤硫酸铝 ⑥碳酸氢钠。请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是 (填序号)。
(2)已知T℃,纯水中c(H+)=1×10-6.5 mol·L-1,则T℃ (填“>”、“<”、“=”)25℃。在T℃时,将pH = 11的③溶液a L与pH = 1的①溶液b L混合(忽略混合后溶液体积的变化),若所得溶液的pH = 10,则a:b = 。
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是 ,产生该现象的原因是 (用离子方程式解释原因)。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
(2)④、⑤、⑥、⑦五种溶液中NH4+浓度由大到小的顺序是(填序号)
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”) 25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省武汉市重点中学高二上学期期中考试化学试卷(带解析) 题型:填空题
(10分,每空2分)现有浓度均为0.1 mol/L的下列溶液:①醋酸、②硫酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦硫酸铵,⑧氨水,请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由小到大的顺序是(填序号)__________________。
(2)④⑤⑥⑦⑧五种溶液中NH4+浓度由小到大的顺序是(填序号)__________________ 。
(3)将③和④等体积混合后,混合液中各离子浓度由小到大的顺序是__________________。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)__________________25℃。在t℃时将pH=2的H2SO4的溶液a L与pH=11的NaOH溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=___________ 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年上江西省新余一中高二上学期第一次段考化学试卷 题型:单选题
(8分)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)
。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是
。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”) 25℃。在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com