
| ||
| H+ |
| ||
| 128 |
| 144 |
| 128 |
| 144 |
| 9b-a |
| 8 |
| 9b-a |
| 8 |
| ||
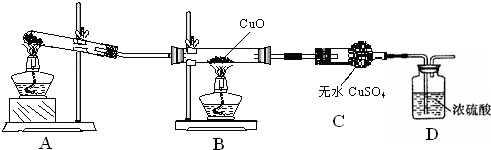
| 18m(CuO)-16m(H2O) |
| m(H2O) |
| 18m(CuO)-16m(H2O) |
| m(H2O) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��72 | B��53 | C��125 | D��19 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| ���¸�ѹ |
| ʱ��/min | c��N2��mol?L-1 | c��H2��mol?L-1 | c��NH3��mol?L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
+ 4 |
- 2 |
+ 4 |
- 2 |
- 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1����ʢ�й���K2Cr2O7��A��B���Թ��зֱ����һ������ϡ���� | |
| ����2�� | |
| ����3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1.2 mol |
| B��1.5 mol |
| C��1.8 mol |
| D��2.5 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ����945kJ/mol���� |
| ������ |
 +
+
| ����498kJ/mol���� |
| ������ |
 +
+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������B��ʾ��Ӧ��ƽ������Ϊ0.3 mol?L-1?s-1 |
| B��2 sʱ�����ܶ�����ʼʱ�����ܶ�֮��Ϊ3��2 |
| C��2 sʱ����A��ת����Ϊ70% |
| D��2 sʱ����B��Ũ��Ϊ0.7 mol?L-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com