
| A.一定有SO2-4 | B.SO2-4、SO2-3或Ag+中至少有一种 |
| C.一定无Ag+ | D.可能有CO2-3 |
科目:高中化学 来源:不详 题型:单选题
| A.使甲基橙呈红色的溶液中:S2-、Cl-、NO3-、Na+ |
| B.使石蕊呈蓝色的溶液中:NH4+、Al3+、NO3-、HCO3- |
| C.由水电离出的c(H+)=1×10 -12 mol·L -1的溶液中:K+、Cl-、NO3-、Na+ |
| D.在0.1mol/L的氯化铁溶液中:Ⅰ一、NH4+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
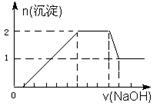
| A.一定存在H+、Mg2+、Al3+、NH+4,一定不存在Na+、SO2-4、Fe3+ |
| B.一定存在H+、Al3+、NH+4、SO2-4,可能存在Na+、Mg2+ |
| C.溶液中c(H+)∶c(Al3+):c(Mg2+)为1∶1∶1 |
| D.溶液中c(H+)∶c(SO2-4)为2∶9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
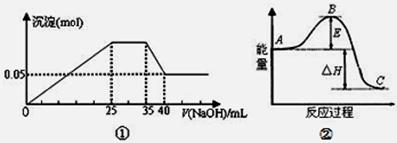
| A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 |
| B.图①中使用的NaOH的浓度为2mol/L |
| C.图②中曲线表示某反应过程的能量变化。若使用催化剂,B点会降低 |
| D.图②中物质A反应生成物质C,△H>0; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②⑤⑥⑦ | B.②③⑤⑦ |
| C.①②③⑥⑦ | D.①②③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe2S3和 Al(OH)3 | B.Fe(OH)3和Al(OH)3 |
| C.FeS、Al(OH)3和S | D.Al2S3、FeS和S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.无色无味 |
| B.无色有刺激性气味 |
| C.属于大气污染物 |
| D.难溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
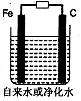
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com