
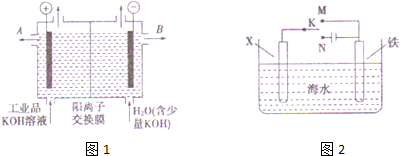
分析 (1)阴极发生还原反应,铜离子获得电子生成Cu;
(2)阳极发生氧化反应,氢氧根离子放电生成水与氧气;
(3)电解池总反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 ,根据电子转移守恒计算Cu的物质的量,再根据m=nM计算Cu的质量,根据电解池总反应式计算H2SO4的物质的量,进而计算氢离子浓度,再根据pH=-lgc(H+)计算;
(4)如用等质量的两块铜片代替石墨作电极,形成电镀池,阳极电极反应式为:Cu-2e-═Cu2+,阴极的电极反应式为:Cu2++2e-═Cu,结合电极反应式计算,电解质溶液浓度不变,溶液pH不变.
解答 解:(1)阴极发生还原反应,铜离子获得电子生成Cu,电极反应式为:2Cu2++4e-=2Cu,
故答案为:还原;2Cu2++4e-=2Cu;
(2)阳极发生氧化反应,氢氧根离子放电生成水与氧气,电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:氧化;4OH--4e-=2H2O+O2↑;
(3)根据电子转移守恒,生成Cu的物质的量为$\frac{0.2mol}{2}$=0.1mol,电解得到Cu的质量为0.1mol×64g/mol=6.4g,电解池总反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 ,可知生成H2SO4的物质的量为0.1mol,溶液中c(H+)=$\frac{0.1mol×2}{2L}$=0.1mol/L,则pH=-lgc(H+)=1,
故答案为:6.4;1;
(4)如用等质量的两块铜片代替石墨作电极,形成电镀池,阳极电极反应式为:Cu-2e-═Cu2+,阴极的电极反应式为:Cu2++2e-═Cu,转移电子0.2mol,阳极参加反应的Cu为0.1mol,阴极析出Cu为0.1mol,则电解后两铜片的质量相差0.2mol×64g/mol=12.8g,由于电解质溶液浓度不变,溶液pH不变,
故答案为:12.8g;不变.
点评 本题考查了电解原理,涉及电极反应式书写与有关计算,关键是理解电解原理明确两极放电顺序,注意电子守恒在电化学计算中应用.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/h | 0 | 1 | ||
| pH | 4.7 | 4.6 | 4.56 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制240mL溶液需要用到250mL容量瓶 | |
| B. | 用四氯化碳萃取碘水中的碘 | |
| C. | 用过滤的方法分离胶体和溶液 | |
| D. | 蒸馏时应将温度计水银球放在与蒸馏烧瓶的支管口相平处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3(g)+3NO(g)═2.5N2(g)+3H20(g)△H=-1808 kJ/mol | |
| B. | 4NH3(g)+6NO(g)═5N2(g)+6H20(g)△H=一 1808 kJ/mol | |
| C. | 4NH3(g)+6NO(g)═5N2(g)+6H20(g)△H=-904 kJ/mol | |
| D. | 4NH3(g)+6NO(g)═5N2(g)+6H20(l)△H=-1808 kJ/m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com