
【题目】在一隔热系统中,初始温度为25℃,向20.00mL0.1000mol/L的氨水中逐滴加入0.1000mol/L的HC1溶液,测得混合溶液的温度变化如图所示。下列相关说法正确的是
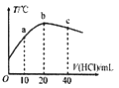
A. 已知:25℃时,0.1000mol/L氨水的电离度为1.33%,该氨水的pH约为12
B. 若a点溶液呈碱性,则a点溶液中:c(NH4+)>c(Cl-)>c(NH3H2O)
C. b点溶液pH=7,c点溶液pH<7
D. b点溶液中: 0.1000mol/L +c(OH-)=c(Cl-)- c(NH3H2O)+c(H+)
【答案】B
【解析】A. 已知:25℃时,0.1000mol/L氨水的电离度为1.33%,NH3·H2O![]() NH4++OH-,则c(OH-)=0.1000mol/L×1.33%=0.00133 mol/L,则c(H+)=
NH4++OH-,则c(OH-)=0.1000mol/L×1.33%=0.00133 mol/L,则c(H+)=![]() =
=![]() ×10-11,该氨水的pH约为11,故A错误;B.a点溶液中溶质为等浓度的氨水和氯化铵,溶液显碱性,氨水的电离程度大于氯化铵的水解程度,所以a点有:c(NH4+)> c(Cl-)>c(NH3H2O),故B正确;C. b点溶液为氯化铵溶液,水解,溶液显酸性,pH<7,故C错误;D.b点盐酸与氨水恰好反应生成氯化铵,氯化铵的浓度为0.0500molL-1,溶液中电荷守恒为c(Cl-)+c(OH-)=c(NH4+)+c(H+),物料守恒为:c(Cl-)= c(NH4+)+ c(NH3H2O),则0.0500molL-1+c(OH-)=c(NH4+)+c(H+)= c(Cl-)- c(NH3H2O)+c(H+),故D错误;
×10-11,该氨水的pH约为11,故A错误;B.a点溶液中溶质为等浓度的氨水和氯化铵,溶液显碱性,氨水的电离程度大于氯化铵的水解程度,所以a点有:c(NH4+)> c(Cl-)>c(NH3H2O),故B正确;C. b点溶液为氯化铵溶液,水解,溶液显酸性,pH<7,故C错误;D.b点盐酸与氨水恰好反应生成氯化铵,氯化铵的浓度为0.0500molL-1,溶液中电荷守恒为c(Cl-)+c(OH-)=c(NH4+)+c(H+),物料守恒为:c(Cl-)= c(NH4+)+ c(NH3H2O),则0.0500molL-1+c(OH-)=c(NH4+)+c(H+)= c(Cl-)- c(NH3H2O)+c(H+),故D错误;
故选B。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。

(1)基态Ti原子的价电子轨道表示式为_______。
(2)AlH4-的空间构型为_______________,中心原子Al的轨道杂化方式为________;
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为________________(标明配位键)。
(4)NaH的熔点为800℃,不溶于有机溶剂NaH属于____晶体,其电子式为_____________。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有_____个;NaAlH4晶体的密度为________g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为__________(填化学式)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键与化合物的叙述中,不正确的是
A.离子化合物中一定含有金属离子B.共价化合物一定不含离子键
C.氯化钙含有离子键,不含共价键D.离子化合物中可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从一种含银矿(含Ag、Zn、Cu、Pb及少量SiO2)中提取Ag、Cu及Pb的工艺流程如下:
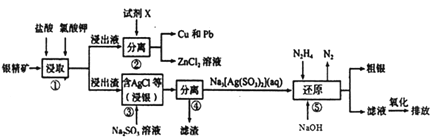
(1)步骤①提高矿物中金属离子浸取率,除可改变盐酸的浓度和氯酸钾的量外,还可采取的措施是__________(写出两种即可)
(2)步骤②中试剂X为______ (填化学式,下同);步骤④滤渣的成分为_______。
(3)步骤③发生反应的化学方程式为____________________。
(4)步骤⑤发生反应的离子方程式为____________________;其中N2H4(肼) 的电子式为____。
(5)“还原”后的“滤液”经氧化后,其中的溶质主要为_______。
(6) 已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。若在AgC1的悬浊液中加入NaCl 固体,AgCl 沉淀的溶解度_____ (填“升高”、“不变”或“降低”),往AgCl 的悬浊液中滴加NaI溶液,当AgCl 开始转化为AgI时,I-的浓度必须不低于_____mol/L (不用化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________。
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______,其化学式为________。
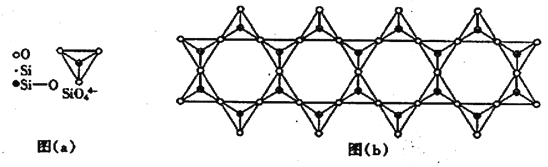
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO |
|
|
电离平衡常数 |
|
|
|
|
(1)室温下![]()
![]()
![]()
![]()
![]() 溶液的pH由大到小的关系为______.
溶液的pH由大到小的关系为______.
(2)浓度均为![]() 的
的![]() 和
和![]() 的混合溶液中,
的混合溶液中, ![]() 、
、![]() 、
、![]() 、
、![]() 浓度从大到小的顺序为______.
浓度从大到小的顺序为______.
(3)少量![]() 通入到过量的NaClO溶液中发生反应的离子方程式______.
通入到过量的NaClO溶液中发生反应的离子方程式______.
(4)常温下, ![]() 的HCOOH溶液与
的HCOOH溶液与![]() 的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为______.
的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com