
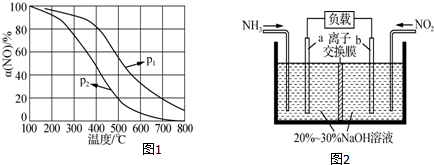
分析 (1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1 269.02kJ•mol-1;目标反应的反应热为:$\frac{②×5-①×3}{2}$;
②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动;平衡常数的表达式应为生成物浓度的幂次方之积比上反应物浓度的幂次方之积;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;
(2)电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48L NH3的物质的量为:0.2mol,根据4NH3~3NO2进行计算;
(3)NaHS再与NaVO3反应生浅黄色沉淀是硫单质和Na2V4O9,根据得失电子守恒,得化学方程式为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH.
解答 解:(1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1 269.02kJ•mol-1;目标反应的反应热为:$\frac{②×5-①×3}{2}$=1811.63 kJ•mol-1,故答案为:=-1811.63 kJ•mol-1;
②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动,所以p1>p2;NO被O2氧化为NO2,方程式为:2NO+O2?2NO2,则平衡常数的表达式K=$\frac{c(NO{\;}_{2}){\;}^{2}}{c(NO){\;}^{2}c(O{\;}_{2})}$;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;故答案为:>;$\frac{c(NO{\;}_{2}){\;}^{2}}{c(NO){\;}^{2}c(O{\;}_{2})}$;NO2几乎完全分解;
(2)电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48L NH3的物质的量为:0.2mol,根据4NH3~3NO2,所以被消除的NO2的物质的量为$\frac{3}{4}$=0.15mol,故答案为:2NO2+8e-+4H2O═8OH-+N2;0.15;
(3)NaHS再与NaVO3反应生浅黄色沉淀是硫单质和Na2V4O9,根据得失电子守恒,得化学方程式为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH,
故答案为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH.
点评 本题较为综合,涉及考查盖斯定律的应用、依据图象分析平衡移动的原因、及电极反应式书写,为高考常见题型,侧重于学生的分析能力和计算能力的考查,易错题为(2)题,会根据化合价的变化确定NO2的电极,然后书写电极反应式.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
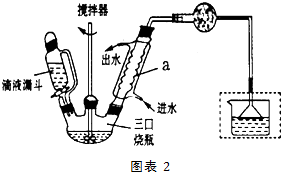
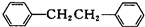 )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
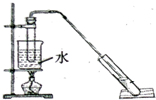 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.某兴趣小组用无水乙醇和冰醋酸制备乙酸乙酯,相关物质的数据如下:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.某兴趣小组用无水乙醇和冰醋酸制备乙酸乙酯,相关物质的数据如下:| 物质 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 分子量 | 46 | 60 | 88 |
| 沸点(℃) | 78.5 | 117.9 | 77.1 |
| 密度(g/cm3) | 0.789 | 1.05 | 0.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
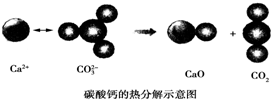
| A. | CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量 | |
| B. | 由该反应可推出凡是需要加热才发生的反应均为吸热反应 | |
| C. | 该反应的焓变大于零 | |
| D. | 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com