
| A、海水提取MgCl2 |
| B、接触法制硫酸 |
| C、工业制普通玻璃 |
| D、氨碱法制纯碱 |
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| ||


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、反应物的总能量一定高于生成物的总能量 |
| B、一个反应是放热还是吸热取决于该反应的发生是否需要加热 |
| C、化学反应过程中的能量变化除了热能外,也可以是光能、电能等 |
| D、若旧键断裂吸收的总能量小于新键形成放出的总能量,则该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 |
| B、不能用稀硝酸与锌反应制氢气--强氧化性 |
| C、要用棕色瓶盛装浓硝酸--不稳定性 |
| D、能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、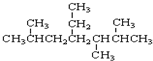 的名称是2,5,6-三甲基-4-乙基庚烷 的名称是2,5,6-三甲基-4-乙基庚烷 |
| B、常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 |
C、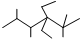 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 |
| D、2,3-二甲基-1-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓H2SO4沾到皮肤上,先用干抹布擦干,再用大量水冲洗 |
| B、实验室固体物质着火可以用细沙覆盖,液体物质着火可以用湿抹布扑盖 |
| C、H2还原金属氧化物时,需要先通H2,然后检验H2纯度,再加热金属氧化物 |
| D、闻气体气味时,用手在集气瓶口轻轻扇动,让少量气体飘进鼻孔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO4═Na++H++SO42- |
| B、KClO3═K++Cl5++3O2- |
| C、Ba(OH)2═Ba2++(OH)22- |
| D、H2SO4═H2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,某容器被分隔成A、B两部分.A容积固定不变,B有可移动的活塞.现向A中充入2mol SO2和1mol O2,向B中充入2mol SO3和1mol N2,在相同条件下发生可逆反应:2SO2+O2?2SO3(g).
如图所示,某容器被分隔成A、B两部分.A容积固定不变,B有可移动的活塞.现向A中充入2mol SO2和1mol O2,向B中充入2mol SO3和1mol N2,在相同条件下发生可逆反应:2SO2+O2?2SO3(g).查看答案和解析>>
科目:高中化学 来源: 题型:
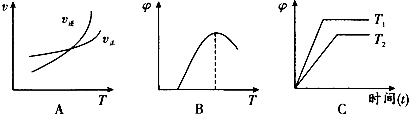
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com