
下列关于乙烯和聚乙烯的叙述中正确的是( )
A.二者都能使溴水褪色,性质相似
B.二者互为同分异构体
C.二者最简式相同
D.相同质量的两种物质燃烧耗氧气量不同
科目:高中化学 来源: 题型:
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
 A.Y、Z、W具有相同电子层结构的离子,其半径依次增大
A.Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.X与Y只能形成一种化合物
C.Y、R分别与X形成的简单化合物的热稳定性:XmY>XmR
D.W、R的最高价氧化物的水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
苏丹红一号(sudan Ⅰ)是一种偶氮染料,不能作为食品添加剂使用。它是由苯胺和2萘酚为主要原料制备的,它们的结构简式如图所示:
 (1)苏丹红一号的分子式为_______________________________。
(1)苏丹红一号的分子式为_______________________________。
(2)在下面化合物A~D中,与2萘酚互为同分异构体的有(填字母代号)________。

(3)上述化合物C含有的官能团的名称是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为:__________________。
(2)已知燃料电池的总反应式为CH4+2O2+2KOH===K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-===CO +7H2O,这个电极是燃料电池的________(填“正极”或“负极”),另一个电极上的电极反应式为:___________________________。
+7H2O,这个电极是燃料电池的________(填“正极”或“负极”),另一个电极上的电极反应式为:___________________________。
(3)随着电池不断放电,电解质溶液的碱性________(填“增大”“减小”或“不变”)。
(4)通常情况下,甲烷燃料电池的能量利用率______(填“大于”“小于”或“等于”)甲烷燃烧的能量利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.天然气和沼气的主要成分是甲烷
B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
C.纤维素、油脂和蛋白质在一定条件下都能水解
D.葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
作为国家正在实施的“西气东输”工程终点站,上海将逐步改变以煤、石油为主的能源结构,这对解决城市环境污染意义重大。目前,上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为民用燃料。管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4,它们的燃烧反应如下:
2CO+O2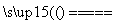 2CO2
2CO2
2H2+O2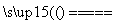 2H2O
2H2O
CH4+2O2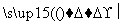 CO2+2H2O
CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是________,因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是________进风口(填“增大”或“减小”),如不做改进,可能产生的不良后果是_____________。
管道煤气中含有烃类,除甲烷之外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表。
| 乙烷 | 丙烷 | 丁烷 | |
| 烷点/℃ | -183.3 | -189.7 | -138.4 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 |
试根据表中某个关键数据解释:冬天严寒季节有时管道煤气火焰很小,并且呈断续状态的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电子云的叙述中,正确的是( )
A.电子云形象地表示了电子在核外某处单位体积内出现的概率
B.电子云直观地表示了核外电子的数目
C. 1s电子云界面图是一个球面,表示在这个球面以外,电子出现的概率为零
D.电子云图中的小黑点表示了电子运动的轨迹
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有________种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是_______。
(2)元素Y与氢元素形成一种离子YH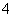 ,写出该微粒的电子式 ________(用元素符号表示)。
,写出该微粒的电子式 ________(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种酸的是________,理由是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
请运用元素周期律知识完成下列各题。
(1)同一周期中,从左到右,元素的电负性逐渐________;同一主族中,从上到下,元素的电负性逐渐________。所以,元素的电负性随原子序数的递增呈________变化。
(2)短周期元素中,由电负性最大的元素与电负性最小的元素形成的化合物的化学式为________,用电子式表示该化合物的形成过程:____________________________________。
(3)表中符合“对角线规则”的元素有Li和________、Be和________、B和________,它们的性质分别有一定的相似性,其原因是____________________,写出Be(OH)2与强酸及强碱反应的离子方程式:____________________________________。
(4)一般认为,两成键元素间电负性差值大于1.7时形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。判断Mg3N2、SO2、AlCl3、CS2、MgO是离子化合物还是共价化合物。
离子化合物___________________________________________
共价化合物___________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com