
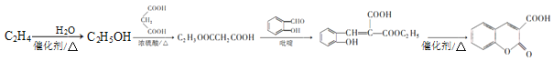
【题目】香豆素-3-羧酸是香豆素的重要衍生物,工业上利用一种常见石油化工原料A(C2H4)合成香豆素-3-羧酸,合成路线如下(部分产物及条件未列出):

已知:①B能发生银镜反应,D属于常见的高分子,G分子中含有2个六元环
②RCHO+CH2(COOR′)2![]() RCH=C(COOR′)2
RCH=C(COOR′)2
③RCOOR′+R″OH![]() RCOOR″+R′OH
RCOOR″+R′OH
回答下列问题:
(1)B的化学名称是__________。
(2)香豆素-3-羧酸含有的含氧官能团名称是________,反应①—④中属于取代反应的是________。
(3)反应⑦的化学方程式为________________________________________。
(4)下列有关说法正确的是___________ (填标号)。
a.核磁共振仪可测出E有5种类型的氢原子
b.质谱仪可检测F的最大质荷比的值为236
c.G分子中的所有碳原子可能共面
d.化合物W在一定条件下可发生加聚反应
(5)H是 的同系物,相对分子质量比
的同系物,相对分子质量比 多14,其同分异构体分子结构具有下列特征:①含有苯环;②能发生水解反应和银镜反应。满足上述条件的H同分异构体共有___________种(不含立体异构),核磁共振氢谱出现4组峰的结构简式为____________。
多14,其同分异构体分子结构具有下列特征:①含有苯环;②能发生水解反应和银镜反应。满足上述条件的H同分异构体共有___________种(不含立体异构),核磁共振氢谱出现4组峰的结构简式为____________。
(6)观察上述流程,结合相关信息,设计只允许四步由A合成香豆素-3-羧酸的合成路线。请写出合成路线_________。(二元羧酸可部分酯化)
【答案】乙醛 酯基、羧基 ④ 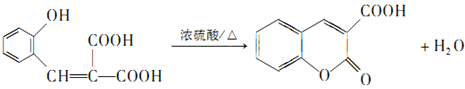 cd 4
cd 4 ![]()
【解析】
由A的分子式可知A为乙烯,B能发生银镜反应,则B为乙醛,C与丙二酸发生酯化反应生成E,结合E的分子式可知,C为乙醇、E为C2H5OOCH2COOC2H5,D属于常见的高分子为聚乙烯,E与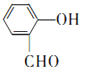 发生已知②的反应生成F,则F为
发生已知②的反应生成F,则F为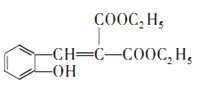 ,F发生已知③的反应生成G,G分子中含有2个六元环,则G为
,F发生已知③的反应生成G,G分子中含有2个六元环,则G为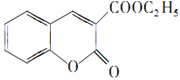 ,G在足量NaOH溶液中发生水解反应、酸化后得到W,结合香豆素-3-羧酸的结构简式,可知W为
,G在足量NaOH溶液中发生水解反应、酸化后得到W,结合香豆素-3-羧酸的结构简式,可知W为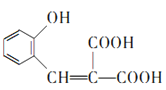 。
。
(1)B能发生银镜反应,为乙醛。
(2)观察香豆素-3-羧酸分子结构,含有的含氧官能团名称为羧基和酯基;由上分析可知:反应①为加聚反应,反应②为氧化反应,反应③为加成或还原反应,反应④为酯化反应或取代反应。
(3)反应⑦为分子内形成内酯的反应,根据酯化反条件可写出反应方程式。
(4)结合以上分析可知:E为C2H5OOCH2COOC2H5,F为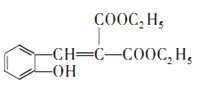 ,W为
,W为 ,G为
,G为 ;
;
a.核磁共振仪可测定E有3种类型的氢原子,a错误;b.F的分子式为C14H16O5,相对分子质量为264,质谱仪可检测最大质荷比的值为264,b错误;c.苯环中的碳共平面,碳碳双键及与之相连的碳有可能共平面,结合单键可以旋转,因此G分子中的碳原子均可以共面,c正确;d.化合物W含有碳碳双键,可以发生加聚反应得到线型高分子化合物,d正确;正确选项cd。
(5)H是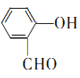 的同系物,相对分子质量比
的同系物,相对分子质量比 多14,说明多了一个CH2原子团,由信息①②说明符合条件的H分子含有苯环、酯基、醛基,结合H的分子式,可知H中含甲酸酯基。若苯环上只有一个侧链,则为-CH2OOCH,只有1种结构,若有两个侧链,则为一CH3、-OOCH,苯环上有邻、间、对3种位置,故共4种;核磁共振氢谱出现4组峰,说明分子结构对称,故结构简式为
多14,说明多了一个CH2原子团,由信息①②说明符合条件的H分子含有苯环、酯基、醛基,结合H的分子式,可知H中含甲酸酯基。若苯环上只有一个侧链,则为-CH2OOCH,只有1种结构,若有两个侧链,则为一CH3、-OOCH,苯环上有邻、间、对3种位置,故共4种;核磁共振氢谱出现4组峰,说明分子结构对称,故结构简式为![]() 。
。
(6)仔细观察由乙烯合成香豆素-3-羧酸的过程,结合相关信息,当乙醇与丙二酸的物质的量的比为1:1,可以用4步即可完成合成路线:乙烯先水化生成乙醇,乙醇与丙二酸反应生成C2H5OOCCH2 COOH,该有机物与邻羟基苯甲醛反应生成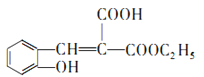 ,根据已知③RCOOR′+R″OH
,根据已知③RCOOR′+R″OH![]() RCOOR"+R′OH可知
RCOOR"+R′OH可知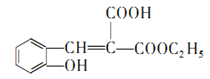 在一定条件下发生反应生成
在一定条件下发生反应生成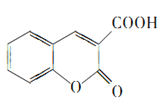 。
。


科目:高中化学 来源: 题型:
【题目】下列说法中,符合VIIA族元素结构与性质特征的是( )
A.原子易形成-2价阴离子
B.单质均为双原子分子,具有氧化性
C.原子半径随原子序数递增逐渐减小
D.氢化物的稳定性随原子电子层数递增依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质中:
①HCl、②N2、③NH3、④Na2O2、⑤C2H4、⑥NaOH、⑦Ar
(1)只存在极性键的分子是____;只由非极性键构成的非极性分子是____;(填序号,下同)。
(2)既存在极性键又存在非极性键的分子是________。
(3)只存在σ键的分子是________,既存在σ键又存在π键的分子是________。
(4)不存在化学键的是_________。
(5)既存在离子键又存在极性键的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴加少量NaOH溶液,无明显变化;(2)继续滴加NaOH溶液,有白色胶状沉淀生成;(3)滴加过量的NaOH溶液,白色胶状沉淀明显减少。实验小组经定量分析,得出如图所示沉淀的物质的量与滴加NaOH溶液体积的关系。下列说法错误的是( )

A. 该未知溶液中至少含有3种阳离子
B. NaOH溶液的物质的量浓度为5 mol·L-1
C. 若另一种离子为二价阳离子,则a=10
D. 若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是____________。
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式
固体B_________________;沉淀D __________________;
溶液E_________________________________________。
(3)写出①、④两个反应的化学方程式
①__________________________________;④_____________________________。
(4)写出②、③两个反应的离子方程式
②_________________________________;③______________________________。
(5)设计实验检验溶液F中所含溶质:______________________________________
(6)分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3__________________________Fe2O3____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴被誉为战略物资,有出色的性能和广泛的应用.以水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、A12O3、MnO等)制取钴产品的工艺流程如下:

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Mn(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程、Co2O3发生反应的离子方程式:_________________________。
(2)写出NaC1O3发生反应的主要离子方程式:______________________________;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________________;萃取剂使用的最佳pH范围是__________(填代号)。
A.1.0~1.5 B.2.0~2.5 C.3.0~3.5 D.4.0~4.5

(5)“沉钴”时生成CoCO3的离子方程式为__________________________________。
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业生产过程中,涉及SO2转化为SO3的反应,某化学研究小组在450 ℃时,在一容积为10 L 的恒容密闭容器中研究该可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),得出的相关数据如表所示:
2SO3(g),得出的相关数据如表所示:
时间/min | n(SO2)/mol | n(O2)/mol | n(SO3)/mol |
0 | 0.200 | 0.100 | 0 |
10 | 0.190 | 0.095 | 0.010 |
15 | 0.160 | 0.080 | 0.040 |
20 | 0.160 | 0.080 | 0.040 |
25 | 0.150 | 0.150 | 0.050 |
根据表中数据,下列判断正确的是
A. 0~10 min内的反应速率可表示为v(SO2)=0.010 mol/(L·min)
B. 15~20 min内,正、逆反应速率不相等
C. 工业上常用增加SO2的量来提高O2的转化率
D. 20~25 min内,数据变化的原因可能是增加了O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以黄铜矿(主要成分CuFeS2)为原料进行如下实验探究.为测定黄铜矿中硫元素的质量分数,将m1g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品.

(1)锥形瓶A内所盛试剂是__________;装置B的作用是__________;锥形瓶D内发生反应的离子方程式为__________。
(2)反应结束后将锥形瓶D中的溶液进行如下处理:

如图则向锥形瓶D中加入过量H2O2溶液反应的离子方程式为__________;操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法__________;该黄铜矿中硫元素的质量分数为__________(用含m1、m2的代数式表示).
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是__________
A.KSCN溶液、氯水B.稀盐酸、KMnO4溶液
C.稀硫酸、KMnO4溶液D.NaOH溶液
(4)已知:Cu+在强酸性环境中会发生反应生成Cu和Cu2+.设计实验方案验证泡铜中是否含有Cu2O__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com