
【题目】Ⅰ.(1)按要求写出下列反应的化学方程式:
①由饱和FeCl3溶液制备Fe(OH)3胶体_______________________________。
②氢氟酸腐蚀玻璃____________________________________。
(2)按要求写出下列反应的离子方程式:
①制漂白粉(有效成分为次氯酸钙)____________________________________。
②用硫氰化钾溶液检验溶液中含有Fe3+____________________________________。
③向Ba(OH)2溶液中逐滴加入NaHSO4溶液至溶液恰呈中性____________________________________;
Ⅱ.已知还原性是I->Fe2+>Br-,1L某溶液中含有FeI2和FeBr2两种溶质,分析知其中Fe2+、I-、Br-的物质的量比为1:1:1。取出1/10体积该混合溶液向其中通入氯气,发现吸收3.36L(标况下)的氯气后溶液中的溶质离子刚好完全被氧化得到I2、Br2、Fe3+。请回答:
①试写出此反应过程中第二步反应的离子方程式__________。
②求原混合溶液中各溶质的物质的量浓度______________。
③当溶液中Br-有一半被氧化时,通入的氯气在标况下所占体积是________升,此时溶液中溶质的物质的量浓度约为(不考虑溴和碘单质的溶解)________
【答案】 FeCl3+3H2O![]() Fe(OH)3(胶体) +3HCl SiO2+4HF==SiF4↑+ 2H2O Cl2+Ca(OH)2==Ca2++Cl-+ClO-+H2O Fe3++3SCN-
Fe(OH)3(胶体) +3HCl SiO2+4HF==SiF4↑+ 2H2O Cl2+Ca(OH)2==Ca2++Cl-+ClO-+H2O Fe3++3SCN-![]() Fe(SCN)3 2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O Cl2+2Fe2+= 2Fe3++2Cl- c(FeI2)=c(FeBr2)=0.5mol/L V(Cl2)=28L c(FeCl3)=5/6mol/L(或0.83mol/L) 、 c(FeBr3)=1/6mol/L(或0.17mol/L)
Fe(SCN)3 2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O Cl2+2Fe2+= 2Fe3++2Cl- c(FeI2)=c(FeBr2)=0.5mol/L V(Cl2)=28L c(FeCl3)=5/6mol/L(或0.83mol/L) 、 c(FeBr3)=1/6mol/L(或0.17mol/L)
【解析】Ⅰ.(1)①制取氢氧化铁胶体的方法是将氯化铁饱和溶液滴加至沸腾的水中,发生水解反应,方程式如下:FeCl3+3H2O![]() Fe(OH)3(胶体) +3HCl。②氢氟酸腐蚀玻璃,主要是氢氟酸和玻璃中的二氧化硅反应,得到四氟化硅气体和水,方程式为:SiO2+4HF==SiF4↑+ 2H2O。
Fe(OH)3(胶体) +3HCl。②氢氟酸腐蚀玻璃,主要是氢氟酸和玻璃中的二氧化硅反应,得到四氟化硅气体和水,方程式为:SiO2+4HF==SiF4↑+ 2H2O。
(2)①制取漂白粉的方法是将氯气通入到石灰乳中,方程式为:2Cl2+2Ca(OH)2==CaCl2+Ca(ClO-)2+2H2O,所以离子方程式为:Cl2+Ca(OH)2==Ca2++Cl-+ClO-+H2O(石灰乳是不能拆分的)。
②用硫氰化钾溶液检验溶液中含有Fe3+,是将Fe3+转化为Fe(SCN)3使溶液显红色,离子方程式为:Fe3++3SCN-![]() Fe(SCN)3。
Fe(SCN)3。
③向Ba(OH)2溶液中逐滴加入NaHSO4溶液至溶液恰呈中性,即氢氧根离子和氢离子应该恰好中和,所以氢氧化钡和硫酸氢钠的比例为1:2,方程式为:2NaHSO4+Ba(OH)2==BaSO4↓+2H2O+Na2SO4,离子方程式为:2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O。
Ⅱ. ①已知还原性是I->Fe2+>Br-,通入氯气,氯气应该先与还原性较强的碘离子反应,再将Fe2+氧化,最后反应溴离子,所以第二步反应为:Cl2+2Fe2+= 2Fe3++2Cl-。
②已知:Fe2+、I-、Br-的物质的量比为1:1:1,取出1/10体积该混合溶液向其中通入氯气,发现吸收3.36L(0.15mol)的氯气后溶液中的溶质离子刚好完全被氧化得到I2、Br2、Fe3+;设三种离子反应的物质的量均为Xmol,得到X/2+X/2+X/2=0.15,所以X=0.1mol,得到原来的1L溶液中三种离子的物质的量都是1mol。根据元素守恒得到n(FeI2)=n(FeBr2)=0.5mol,所以c(FeI2)=c(FeBr2)=0.5mol/L。
③当溶液中Br-有一半被氧化时,代表反应的碘离子和Fe2+都是1mol,反应的溴离子为0.5mol,带入各自的反应方程式进行计算,得到反应的氯气为1.25mol,在标况下所占体积是28L。根据元素守恒,反应后溶液中的Fe3+为1mol/L,Br-被氧化了一半,剩余的浓度为0.5mol/L,所有的氯气都转化为氯离子,所以氯离子浓度为2.5mol/L,由上得到:FeCl3为2.5÷3=5/6mol/L,FeBr3为0.5÷3=1/6mol/L。


科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示.若1mol X分别与H2 , Na,NaOH,NaHCO3恰好完全反应,则消耗H2 , Na,NaOH,NaHCO3的物质的量之比为( ) 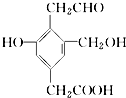
A.4:3:2:1
B.3:3:2:1
C.4:3:2:2
D.3:3:2:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有2 mL氯化铁溶液的试管中,加入过量铁粉,振荡试管。充分反应后滴入几滴硫氰化钾溶液,观察到的现象是_________,反应的离子方程式_________;把上层清液倒入另一试管,再加入几滴氯水,又观察到的现象是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一实例能证明微量元素是生命活动所必需的( )
A. 镁是植物叶绿素的组成成分
B. 人体缺Fe会导致贫血
C. 哺乳动物血液中钙盐含量太低会抽搐
D. 缺磷会影响生物核苷酸的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。请回答下列问题:
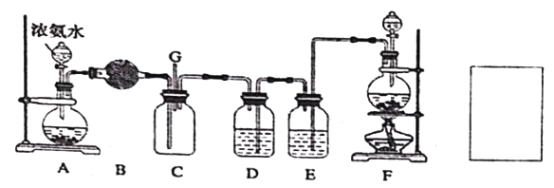
(1)装置F 为实验室制备氯气的装置,请写出实验室制备氯气的化学方程式________;
(2)装置A 中烧瓶内的固体可选用_____;装置B 中试剂可选用_____;
a.碱石灰 b.无水CuSO4 c.无水CaCl2 d.浓硫酸
(3)E 装置选用试剂的名称_____;
(4)装置C 内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。
①请写出反应的化学方程式______________;
②并用单线桥表示电子转移的方向和数目。
③当有amol氯气参加反应时,转移的电子总数为b 个,则阿伏加德罗数常数表示为______________;(用含a、b 的代数式表示,结果注明单位)
(5)通入C 装置的两根导管左边较长、右边较短,目的是______________;从装置C 的G 处逸出的尾气中可能含有黄绿色的有毒气体,请在上图右边方框中画图,表示处理该气体的方法,并标出气流方向和所用试剂的名称。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像的说法正确的是
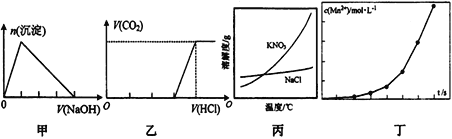
A. 图甲可表示:向某AlCl3溶液中滴加过量的NaOH 溶液,生成沉淀的物质的量与滴加NaOH 溶液体积的关系
B. 图乙可表示:向含等物质的量的NaOH 和Na2CO3的混合溶液中滴加过量的稀盐酸,生成气体的体积与滴加HCl 溶液体积的关系
C. 根据图丙,除去混在KNO3中少量的NaCl可用“蒸发浓缩、趁热过滤”的方法
D. 图丁可表示:将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,反应液中Mn2+的浓度随反应时间t的变化关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.2molL﹣1盐酸
D.提高溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是( )
A.CH2═CH2+HCl ![]() CH3CH2Cl
CH3CH2Cl
B.2CH3CHO+O2 ![]() 2CH3COOH
2CH3COOH
C.![]() +Br2
+Br2 ![]()
![]() ﹣Br+HBr
﹣Br+HBr
D.CH3CH2Br+NaOH ![]() CH2═CH2↑+NaBr+H2O
CH2═CH2↑+NaBr+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com