
【题目】“奥司他韦”是化学家们合成的药品,能抗病毒,用于治疗流感。于2001年在我国投入使用。其合成路线如下
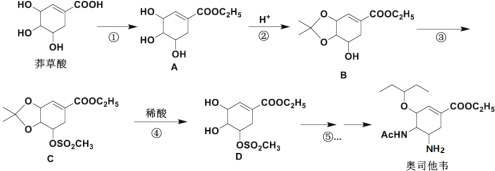
已知: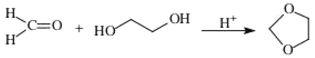 +H2O
+H2O
(1)莽草酸的含氧官能团名称有:__________,反应③的反应类型:_________。
(2)反应①的反应试剂和反应条件:_____________________ 。
(3)请写出反应②的化学方程式:____________________________________ 。
(4)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有_____种。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。C中有_____个手性碳。
(6)设计由对甲基苯甲醛制备对醛基苯甲酸![]() 的合成路线_________________
的合成路线_________________
【答案】羟基、羧基 取代反应 乙醇、浓硫酸,加热 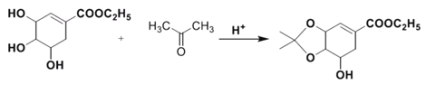 +H2O 17 3
+H2O 17 3 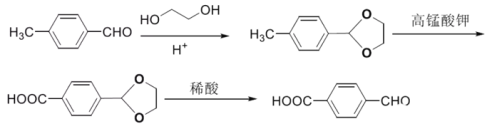
【解析】
莽草酸与乙醇在浓硫酸作催化剂加热条件下发生酯化反应生成A,结合已知信息,A与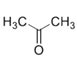 在酸性条件下反应生成B,B与HO-SO2CH3发生取代反应生成C,C加入稀酸作用下生成D在经过一系列反应最终得到奥斯维他,据此分析解答。
在酸性条件下反应生成B,B与HO-SO2CH3发生取代反应生成C,C加入稀酸作用下生成D在经过一系列反应最终得到奥斯维他,据此分析解答。
(1)莽草酸的结构简式为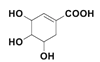 ,含氧官能团名称有:羟基、羧基;根据分析反应③的反应类型为取代反应;
,含氧官能团名称有:羟基、羧基;根据分析反应③的反应类型为取代反应;
(2)根据分析,反应①为莽草酸与乙醇在浓硫酸作催化剂加热条件下发生酯化反应生成A,反应试剂和反应条件:乙醇、浓硫酸,加热;
(3)根据分析,反应②为A与 在酸性条件下反应生成B的化学方程式:
在酸性条件下反应生成B的化学方程式: +H2O;
+H2O;
(4)B的结构简式为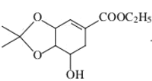 ,芳香化合物X是B的同分异构体,则X中有苯环,官能团只含酚羟基,则X中有5个-OH,并直接连在苯环上,则X为
,芳香化合物X是B的同分异构体,则X中有苯环,官能团只含酚羟基,则X中有5个-OH,并直接连在苯环上,则X为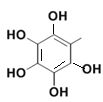 和-C6H13,根据题意
和-C6H13,根据题意 在X的结构中为一个固定原子团结构,可将
在X的结构中为一个固定原子团结构,可将 看作卤素原子,如Cl原子,则该有机物可写为C6H13Cl(Cl代表
看作卤素原子,如Cl原子,则该有机物可写为C6H13Cl(Cl代表 原子团),故同分异构体情况分别如下:正己烷分子中含有3类氢原子,2-甲基戊烷分子中含有5类氢原子,3-甲基戊烷分子中含有4类氢原子,2,2-二甲基丁烷分子中含有3类氢原子,2,3-二甲基丁烷分子中含有2类氢原子,则该有机物符合要求的同分异构体的数目为17个;
原子团),故同分异构体情况分别如下:正己烷分子中含有3类氢原子,2-甲基戊烷分子中含有5类氢原子,3-甲基戊烷分子中含有4类氢原子,2,2-二甲基丁烷分子中含有3类氢原子,2,3-二甲基丁烷分子中含有2类氢原子,则该有机物符合要求的同分异构体的数目为17个;
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。C的结构简式为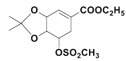 ,其中是手性碳的如图所示
,其中是手性碳的如图所示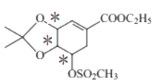 ,有3个手性碳;
,有3个手性碳;
(6)结合上述流程,由对甲基苯甲醛制备对醛基苯甲酸![]() 的合成路线为:
的合成路线为: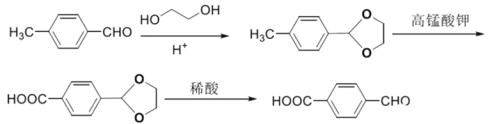 。
。


科目:高中化学 来源: 题型:
【题目】青蒿素是我国药学家屠呦呦在1971年发现的一种含有过氧基团的倍半萜内酯的无色针状晶体,不溶于水,易溶于乙醇、石油醚、苯等有机溶剂,熔点为156℃,沸点389.9℃,热稳定性差。一种超声提取青蒿素的主要工艺流程如图:
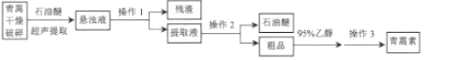
已知:石油醚的沸点为30~80℃;青蒿素在95%乙醇中的溶解度随温度的升高而增大。
(1)超声提取的原理是在强大的超声波作用下,使青蒿细胞乳化、击碎、扩散,其优点有______等(答一点即可)。
(2)操作1的名称是______。
操作2应选的合理装置是______(填标号),青蒿素粗品在______(仪器名称)中。
操作3的步骤是蒸发浓缩、______、过滤、洗涤、干燥。
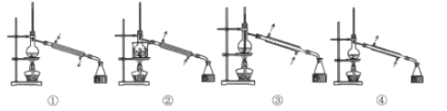
(3)操作3中若温度过高,会降低青蒿素的产率,其原因可能是______。
(4)青蒿素只含C、H、O三种元素。某学生采用如图装置(加热及夹持装置省略)测定其最简式CxHyOz。
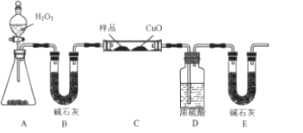
①该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是______。
②取2.82g青蒿素样品,用改进后的装置进行实验。实验后测得装置D增重1.98g,装置E增重6.60g,则x:y:z=______(填最简整数比),要确定青蒿素的分子式,还需测量的数据是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定 K2[Cu(C2O4)2]·2H2O(M=354g/mol)含量,准确称取试样1.000g溶于 NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入10mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,重复试验,平均消耗 KMnO4标准液20.00mL。已知:C2O42-酸性条件下被MnO4-氧化为CO2,杂质不参加反应。该样品中K2[Cu(C2O4)2]·2H2O的质量分数为____________(保留小数点后两位) ,写出简要计算过程:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
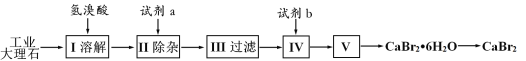
下列说法错误的是
A.已知步骤Ⅲ的滤液中不含NH4+,步骤II加入的试剂a是石灰水
B.步骤II控制溶液的pH约为8.0的主要目的是沉淀过量Ca2+
C.试剂b是氢溴酸,步骤IV的目的是除去过量的氢氧化钙
D.步骤V所含的操作依次是蒸发浓缩,冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
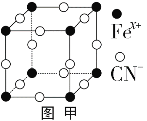
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。
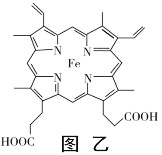
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________
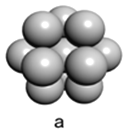
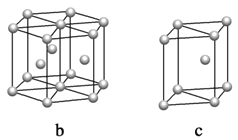
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列各组物质:
①O2和O3 ②CH2=CH-CH3和CH2=CH-CH=CH2 ③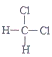 和
和
④11H2O和21H2O ⑤CH3CH2CH3和CH3C(CH3)3 ⑥23592A和质量数为238中子数为146的原子⑦C2H5C≡CCH3和CH3CH=CHCH=CH2
按要求用序号填空
(1)属于同系物的是_______。
(2)属于同分异构体的是________。
(3)属于同位素的是_______。
(4)属于同素异形体的是________。
(5)属于同种物质的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的绝热密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列不能说明该反应达到化学平衡状态的是
2NH3(g) △H<0。下列不能说明该反应达到化学平衡状态的是
A.混合气体的密度不变B.体系温度不变
C.3v逆(NH3)=2v正(H2)D.N2和NH3的浓度的比值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据AgCl、Ag2CrO4的溶度积可得到下图,测量溶液中Cl-的量,常使用AgNO3溶液滴定,Na2CrO4作指示剂。下列表述错误的是
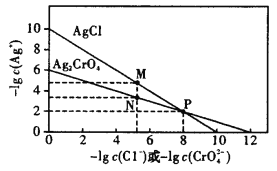
A.由图可知,Ag2CrO4的溶度积小于AgCl的溶度积
B.由图可知,作Cl-的滴定指示剂时,Na2CrO4的浓度不能过大
C.由图可知,只有当c(Ag+)>10-2mol·L-1时,![]() 先沉淀
先沉淀
D.不采用AgNO3溶液滴定测量溶液中I-的量,因为生成的AgI胶体会大量吸附I-,使滴定终点提前
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组用镍触媒废料(主要成分为Ni-Al合金,混有少量Fe、Cu、Zn及有机物) 制备NiO并回收金属资源的流程如下所示:
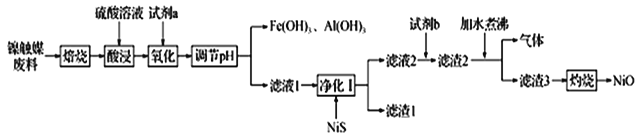
已知:相关数据如表1和表2所示
表1部分难溶电解质的溶度积常数(25℃)
物质 | Ksp | 物质 | Ksp |
Fe(OH)3 | 4.0×10-38 | CuS | 6.3×10-34 |
Fe(OH)2 | 1.8×10-16 | ZnS | 1.6×10-24 |
Al(OH)3 | 1.0×10-33 | NiS | 3.2×10-18 |
Ni(OH)2 | 2.0×10-15 |
表2 原料价格表
物质 | 价格/(元吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
请回答下列问题:
(1)“焙烧”的目的是________________________________。
(2)“试剂a”的名称为__________________;选择该试剂的理由是______。
(3)“氧化”时反应的离子方程式为__________________________________________。
(4)欲使溶液中Fe3+和A13+的浓度均小于等于1.0×10-6 mol L-1,需“调节pH”至少为_______________。
(5)“试剂b”应选择__________,“加水煮沸”时,反应的化学方程式为_______________________________。
(6)氢镍电池是一种应用广泛的二次电池,放电时,该电池的总反应为NiOOH+MH=Ni(OH)2+M,当导线中流过2 mol电子时,理论上负极质量减少__________g。充电时的阳极反应式为_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com