
【题目】过氧化钙是一种在水产养殖中广泛使用的供氧剂。
(1)过氧化钙制备方法很多。
①制备方法一:H2O2溶液与过量的Ca(OH)2悬浊液反应可制备CaO2·8H2O,其化学方程式为:____________________________________________________________。
②制备方法二:利用反应CaC2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O+2NH4Cl,在碱性环境中制取CaO2。NH3·H2O在Ca2+和H2O2的反应中所起的作用是_____________________________________________;该反应需要在冰水浴条件下完成,原因_____________________________________________。
③制备方法三:利用反应Ca(s)+O2 ![]() CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下
CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下
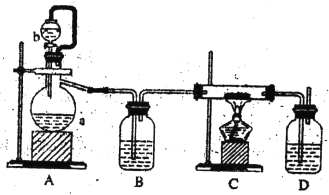
请回答下列问题
装置A中反应的化学方程式为______________________________;
仪器a的名称为_______________;装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是______________________________。
(2)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1。测定原理为:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+40Hˉ=2MnO(OH)2↓;
酸性条件下,MnO(OH)2将Iˉ氧化为I2:MnO(OH)2+2Iˉ+4H+=Mn2++I2+3H2O;
用Na2S2O3标准溶液滴定生成的I2:2S2O32-+I2=S4O32-+2Iˉ
取加过一定量量:CaQ2·8H2O的池塘水样100.0mL,按上述方法测定水中溶氧量,消耗0.020mol·L-1Na2S2O3标准溶液6.75mL。滴定过程中使用的指示剂是_______________;该水样中的溶解氧量(DO)为_______________。
【答案】 Ca(OH)2+H2O2+6H2O=CaO28H2O 中和过氧化氢和Ca2+反应产生的氢离子,促进反应的进行(或中和反应生成的HC1,使反应CaCl2+ H2O2= CaO2+2HC1向右进行) 防止H2O2发生分解 2 H2O2 ![]() 2H2O2+O2↑ (或2Na2O2+2H2O=4NaOH+O2↑) 蒸馏烧瓶 防止空气进入装置C影响产品纯度 淀粉溶液 10.80mg/L
2H2O2+O2↑ (或2Na2O2+2H2O=4NaOH+O2↑) 蒸馏烧瓶 防止空气进入装置C影响产品纯度 淀粉溶液 10.80mg/L
【解析】试题分析:(1)①根据元素守恒,书写H2O2溶液与过量的Ca(OH)2悬浊液反应制备CaO2·8H2O的化学方程式;②CaCl2+ H2O2= CaO2+2HC1,NH3·H2O中和HC1;高温条件下H2O2易分解;③装置A中H2O2分解生成氧气;根据装置图分析仪器a的名称;金属钙能与水反应生成氢氧化钙,浓硫酸具有干燥作用;(2)根据碘能使淀粉变蓝选择指示剂;测定原理的关系式为![]() ,根据关系式计算水样中的溶解氧量;
,根据关系式计算水样中的溶解氧量;
解析:(1)根据元素守恒, H2O2溶液与过量的Ca(OH)2悬浊液反应制备CaO2·8H2O的化学方程式是Ca(OH)2+H2O2+6H2O=CaO28H2O;②CaCl2+ H2O2= CaO2+2HC1,NH3·H2O中和HC1,使反应CaCl2+ H2O2= CaO2+2HC1向右进行;冰水浴可以防止H2O2发生分解;③装置A中H2O2分解生成氧气,反应方程式为2 H2O2 ![]() 2H2O2+O2↑;根据装置图,仪器a的名称是蒸馏烧瓶;钙能与水反应生成氢氧化钙,浓硫酸具有干燥作用,装置D中盛有的液体是浓硫酸,防止空气进入装置C影响产品纯度;(2)碘能使淀粉变蓝,滴定过程中使用的指示剂是淀粉溶液;设水样中的溶解氧气质量是xmg
2H2O2+O2↑;根据装置图,仪器a的名称是蒸馏烧瓶;钙能与水反应生成氢氧化钙,浓硫酸具有干燥作用,装置D中盛有的液体是浓硫酸,防止空气进入装置C影响产品纯度;(2)碘能使淀粉变蓝,滴定过程中使用的指示剂是淀粉溶液;设水样中的溶解氧气质量是xmg
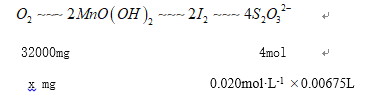
X=1.08 mg 该水样中的溶解氧量(DO)为![]() =10.80mg/L。
=10.80mg/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】按要求做答
(1)甲烷(CH4)的摩尔质量为_________。
(2)0.5mol H2的质量为______,标准状况下该气体的体积为_________。
(3)5molCO2所含氧原子的数目为__________个。
(4)100mL0.25mol/L Na2SO4溶液中Na+的物质的量浓度是__________mol/L。
(5)有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol/L,c(Cl﹣)为1.6mol/L,则Al3+的物质的量浓度为______________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图合理的是

A. 装置①可实现:Cu+2H2O![]() Cu(OH)2+H2↑
Cu(OH)2+H2↑
B. 装置②能构成锌铜原电池
C. 装置③可用于粗铜的电解精炼
D. 装置④可用于浓硫酸干燥氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素性质的比较中,正确的是( )
A.电子层数:P<S<Cl
B.最高正化合价:N<O<F
C.原子半径:C<N<O
D.金属性:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是
A. 月饼因为富含油脂而易发生氧化,保存时常放入装有硅胶的透气袋
B. 《抱朴子·金丹篇》中记载:“丹砂烧之成水银,积变又还为丹砂”。该过程发生了氧化还原反应
C. 酸雨样品露天放置段时间,酸性减弱,是由于酸雨所含成分被氧化
D. 含磷污水是很好的肥料,可灌溉庄稼。可直接排放到自然界水体中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极).下列分析正确的是
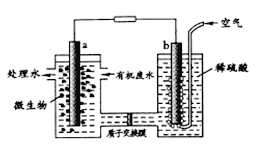
A. a 电极发生反应:H2NCH2CH2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
B. 质子交换膜处H+由右向左移动
C. 该电池在微生物作用下将化学能转化为电能
D. 开始放电时b极附近pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图所示。下列分析正确的是

A. a点对应溶液的导电性比d点强
B. 氢硫酸的酸性比亚硫酸的酸性强
C. 向d点对应的溶液中加入Ba(NO3)2溶液,产生BaSO4白色沉淀
D. H2S饱和溶液的物质的量浓度为0.05 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com