
| A. | 2:3 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
分析 n(CO2)=$\frac{0.672L}{22.4L/mol}$=0.03mol、n(NaOH)=$\frac{1.6g}{40g/mol}$=0.04mol,反应前后各元素原子的个数不变,所以根据C、Na原子守恒进行计算.
解答 解:n(CO2)=$\frac{0.672L}{22.4L/mol}$=0.03mol、n(NaOH)=$\frac{1.6g}{40g/mol}$=0.04mol,反应前后各元素原子的个数不变,设Na2CO3和NaHCO3的物质的量分别是xmol、ymol,
根据C、Na原子守恒计算,
$\left\{\begin{array}{l}{2x+y=0.04}\\{x+y=0.03}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.01}\\{y=0.02}\end{array}\right.$
所以Na2CO3和NaHCO3的物质的量之比=0.01mol:0.02mol=1:2,
故选B.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,利用原子守恒、转移电子守恒进行计算是计算题中常用方法,本题利用原子守恒分析解答即可,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2 | |
| B. | 向FeCl3溶液中加Mg(OH)2:3 Mg(OH)2+2Fe3+=2Fe(OH)3+3 Mg2+ | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害 | |
| C. | 推广使用煤的液化技术,从根本上减少二氧化碳等温室气体的排放 | |
| D. | 明矾常用于水体杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H216O和20 g H218O含有的质子数均为10NA | |
| B. | 1L 1mol/L的KAl(SO4)2溶液中阳离子总数为2NA | |
| C. | 0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA | |
| D. | 反应N2+3H2?2NH3达平衡时,每消耗3molH2同时有2NA个N-H断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H10的烷烃的二氯取代物 | |
| B. | 分子式为C4H10O2的有机物 | |
| C. | 乙苯的一氯取代物 | |
| D. | 和H2加成生成2-甲基戊烷的单烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -109kJ•mol-1 | B. | -218kJ•mol-1 | C. | +109kJ•mol-1 | D. | +218kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
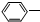 )
)
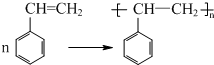 (不要求写出反应条件)
(不要求写出反应条件)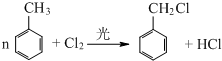 (要求写出反应条件)
(要求写出反应条件)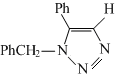 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com