
【题目】氯气是一种重要的化工原料,在生活和生产中的应用十分广泛。
请回答:
(1)在工业上,“氯碱工业”是生产氯气的主要方法。请写出工业制备氯气的离子方程式__________________________。
(2)实验室常用MnO2 与浓盐酸反应制备Cl2,装置如图1所示:
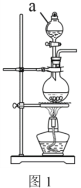
仪器a的名称为______。制备实验开始时,先检査装置气密性,接下来的操作依次是:___________(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(3)为证明Cl2与H2O反应为可逆反应,将生成的气体通入图2所示装置:

①装置A中应加入的试剂是____________。
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是______,仅使用一种试剂证明氯水中HCl和HClO均存在,合适的试剂是_____。
A.AgNO3溶液 B.石蕊试液
C.NaOH溶液 D.品红溶液
③装置C中NaOH溶液的作用是___________________。
(4)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度(残余液体积已知)。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法______。
A.在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量
B.在残余液中加入足量NaHCO3固体,将反应后的气体直接用碱石灰吸收,测定生成的气体的质量
C.在残余液中加入足量锌片,测量生成气体的体积,折算成标准状况下的体积
【答案】2Cl-+2H2O![]() Cl2↑+H2↑+2OH- 分液漏斗 ①③② 饱和食盐水 装置B中的溶液呈黄绿色 B 尾气吸收 C
Cl2↑+H2↑+2OH- 分液漏斗 ①③② 饱和食盐水 装置B中的溶液呈黄绿色 B 尾气吸收 C
【解析】
(1)“氯碱工业”的主要原理为电解饱和食盐水可以得到氢氧化钠、氯气和氢气,反应方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,反应的离子方程式为2Cl-+2H2O
2NaOH+H2↑+Cl2↑,反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
(2)根据装置图,仪器a为分液漏斗,制备实验开始时,先检査装置气密性,然后加入药品,加药顺序一般是先加入固体药品,再加入液药品,最后再加热。所正确的顺序是:①③②,故答案为:分液漏斗;①③②;
(3)①要证明Cl2与H2O反应为可逆反应,需要排除氯化氢的干扰,装置A中应加入饱和食盐水,用来除去气体中的氯化氢,故答案为:饱和食盐水;
②证明可逆反应,需验证在B中反应物和生成物同时存在,证明氯水中有Cl2存在的现象是:装置B中的溶液呈黄绿色;仅使用一种试剂证明氯水中HCl和HClO均存在,利用盐酸的酸性和次氯酸的漂白性,合适的试剂是石蕊试液,先变红色后褪色证明氯化氢和次氯酸的存在,故答案为:装置B中的溶液呈黄绿色;B;
③氯气有毒,不能直接排放,因此装置C中NaOH溶液可以将尾气吸收,防止氯气污染空气,故答案为:尾气吸收;
(4)A.残余液中含有未反应的盐酸和生成的氯化锰,在残余液中加入足量AgNO3溶液,过滤,洗涤,干燥,称量沉淀的质量,包含生成盐中氯离子生成的沉淀,不能测定反应残余液中盐酸的浓度,故A错误;B.残余液中含有未反应的盐酸和生成的氯化锰,在残余液中加入足量NaHCO3固体,盐酸与碳酸氢钠反应放出二氧化碳(含有水蒸气),将反应后的气体直接用碱石灰吸收,测定生成的气体的质量为二氧化碳和水蒸气的质量,不能测定反应残余液中盐酸的浓度,故B错误;C.残余液中含有未反应的盐酸和生成的氯化锰,在残余液中加入足量锌片,只有盐酸与锌反应放出氢气,测量生成气体的体积,折算成标准状况下的体积,可以测定剩余盐酸的浓度,故C正确;故答案为:C。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】请根据官能团的不同对下列有机物进行分类。

(1)芳香烃:________;
(2) 卤代烃:________;
(3) 醇:________;
(4)醛:________;
(5)羧酸:________;
(6)酯:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列结论正确的是( )
①S2-、Cl、S、F四种微粒半径逐渐减小
②HF、HCl、HBr水溶液酸性逐渐增强
③S2-、Cl-、Br-、I-四种离子的还原性逐渐减小
④Cl2、S、P的氧化性逐渐减弱
⑤H2SO4、HClO4、H2CO3的酸性逐渐减弱
A.②④B.③⑤C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如图,说法正确的是

A.分子式C15H21O4
B.既能发生加聚反应,又能发生缩聚反应
C.分子中有两个手性碳原子
D.既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用不相对应的是
A. Na2CO3的水溶液呈碱性,医学上能用作治疗胃酸过多
B. Na2O2能分别与H2O、 CO2反应,可用作供氧剂
C. 生石灰吸水能力强,常用作袋装食品的干燥剂
D. 铝是活泼的金属单质,铝可用于冶炼某些熔点较高的金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7∶17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )
A.金属性:Y>Z
B.离子的还原性:X>W
C.氢化物的沸点:X>W
D.离子半径:Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH![]() CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。

(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(2)丙同学认为只要对实验装置进行适当改进,就可避免对乙烯气体检验的干扰,改进方法为: 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是_______,此时发生反应的化学方程式为: 。
(4)结合资料二、三,有同学认为应将实验装置中烧瓶改成三颈烧瓶并增加两种仪器,这两种仪器是① 。② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对人体健康不会造成危害的事实是
A. 用工业酒精(含甲醇)兑制饮用白酒 B. 用福尔马林浸泡海产品进行防腐保鲜
C. 用二氧化硫漂白食物 D. 在食用盐中加入碘酸钾以消除碘缺乏病
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com