
| A. | 光导纤维和计算机芯片的材料都是二氧化硅 | |
| B. | 蛋白质只含C、H、O、N四种元素 | |
| C. | 可用酸性高锰酸钾溶液除去乙烷中的乙烯 | |
| D. | 液溴易挥发,在存放液溴的试剂瓶中应加水“液封” |
分析 A.计算机芯片主要材料为硅;
B.蛋白质主要含有C、H、O、N四种元素;
C.除杂原则不能引入新杂质;
D.溴易挥发,但溴密度大于水;
解答 解:A.硅是良好的半导体,计算机芯片主要材料为硅,故A错误;
B.蛋白质主要含有C、H、O、N四种元素,还含有S、P等元素,故B错误;
C.高锰酸钾氧化乙烯生成二氧化碳,除去乙烯又引入二氧化碳杂质,故C错误;
D.由于液溴溶于挥发,密度大于水的密度,所以在存放液溴的试剂瓶中应加水封,故D正确;
故选:D.
点评 本题考查了元素化合物知识,熟悉硅、二氧化硅、溴的性质,明确蛋白质所含元素是解题关键,注意烯烃被酸性高锰酸钾氧化得到产物规律,题目难度不大.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量都为4.4g的CH3CHO和CO2含有的分子数均为0.1NA | |
| B. | 1molNa2O2中的离子总数为4NA | |
| C. | 密闭容器中,2molSO2和足量的O2反应转移的电子数为4NA | |
| D. | 1mol苯分子中所含的碳碳双键数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “NO2球”浸泡在冷水中,颜色变浅:2 NO2(g)?N2O4(g)△H<0 | |
| B. | 在反应FeCl3+3KSCN?Fe(SCN)3+3KCl 达平衡后,加入少量KCl固体,平衡逆向移动 | |
| C. | 在两支盛有双氧水的试管中,一支加入FeCl3溶液,反应明显加快,而另一支中加入CuSO4溶液,反应加快但不明显,说明催化剂具有较强选择性 | |
| D. | 用MnO2做催化剂,催化双氧水的分解,是因为MnO2可降低该反应活化能,提高活化分子的百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
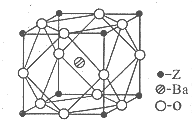 A、B、C、D、Z为周期表前四周期元素,原子序数依次递增,已知:
A、B、C、D、Z为周期表前四周期元素,原子序数依次递增,已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成高效、稳定、廉价的太阳能光电转化材料,是开发利用太阳能的关键 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”的分散质微粒相同 | |
| C. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| D. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 部分特征 |
| A | 单质为相同条件下密度最小的气体 |
| B | 基态原子最外层电子排布式为nsnnpn |
| C | 与元素E处于同一周期且电负性仅次于E |
| D | 位于第三周期且第一电离能最小 |
| E | 双原子分子单质在标准状况下密度为1.4285g/L |
| F | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
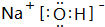 ;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
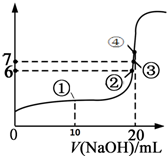 25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:
25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com