
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| 0.01×0.03 |
| 0.01×0.05 |


科目:高中化学 来源: 题型:
| A、③④⑦ | B、④⑤⑦ |
| C、④⑦ | D、④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢键属于化学键,但比较弱 |
| B、任何物质中都一定含有化学键 |
| C、NaOH中有离子键和共价键,则NaOH既属于离子化合物,又属于共价化合物 |
| D、H2O2中既有极性键,又有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol?L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
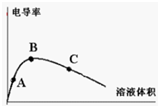 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.| 醋酸浓度(mol?L-1) | 0.0010 | 0.100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
| CH4 | CO
|
C2O
|
|||||||||
NH
|
N2H
|
NO
|
N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50 mL 18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46 NA |
| B、常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 |
| C、浓硫酸能使蔗糖炭化体现了它的吸水性 |
| D、浓硫酸具有强氧化性,SO2具有还原性,所以浓硫酸不能干燥SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com