
 和
和 ,试写出A、B的结构简式.
,试写出A、B的结构简式. 分析 当碳碳双键两端的C上至少含有1个H时能够被氧化成-COOH,不含H原子时被氧化成羰基,由于反应产物只有2种,所以应该生成了2个 、1个
、1个 ,结合A的分子式判断其结构简式,再根据A的结构简式推断出B的结构简式.
,结合A的分子式判断其结构简式,再根据A的结构简式推断出B的结构简式.
解答 解:有机物A的分子式为C10H18,经催化加氢可生成B,其分子式为C10H22,则A分子中含有2个碳碳双键或1个碳碳三键,A经酸性高锰酸钾溶液氧化得到 和
和 ,说明A分子中含有两个碳碳双键,
,说明A分子中含有两个碳碳双键,
当碳碳双键两端的C上至少含有1个H时能够被氧化成-COOH,不含H原子时被氧化成羰基,由于反应产物只有2种,所以应该生成了2个 、1个
、1个 ,则A的结构简式为:
,则A的结构简式为: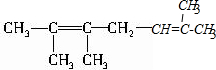 ,
,
A经催化加氢可生成B,则B的结构简式为: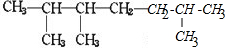 ,
,
答:A的结构简式为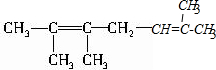 、B的结构简式为
、B的结构简式为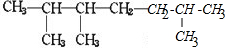 .
.
点评 本题考查了有机物结构简式的确定,题目难度中等,明确烯烃与酸性高锰酸钾的反应原理危机的关键,试题侧重考查学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
 X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:| X | Y | Z | W | |
| A | NaOH | Na2CO3 | NaHCO3 | CO2 |
| B | O2 | CO2 | CO | C |
| C | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| D | S | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素在人体内可水解为葡萄糖,故可做人类的营养物质 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 用硫酸清洗锅炉中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com