
【题目】与氢硫酸混合后无明显现象的是
A.NaOH溶液B.亚硫酸C.FeCl3溶液D.氯水
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】某有机物含有C、H、O三种元素,其蒸气密度是相同条件下CH4密度的3.625倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1.该有机物可以使溴水褪色,能和金属钠发生反应生成H2.求:
(1)该有机物的摩尔质量
(2)该有机物的分子式
(3)该有机物的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种来自石油的重要的有机化工原料,是衡量一个国家石油化工生产水平的标志;E是一种具有果香味的有机物,F是一种高聚物,可制成多种包装材料。(过程中的水或其他物质已省略)
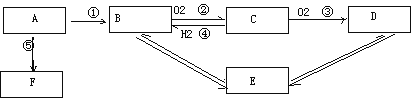
(1)写出反应①的化学方程式_________________________________;反应类型____________;
(2)写出反应B+D→E的化学方程式___________________________反应类型___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解,水解生成Sn02·H20)
的反应为Sn+2Cl2 ![]() SnCl4, Sn也可以与HC1反应生成SnCl2。已知:
SnCl4, Sn也可以与HC1反应生成SnCl2。已知:
物质 | 摩尔质量(g/mol) | 熔点(℃) | 沸点(℃) |
Sn | 119 | 231 | 2260 |
SnCl2 | 190 | 246 | 623 |
SnCl4 | 261 | -30 | 114 |
制备装置如图所示:
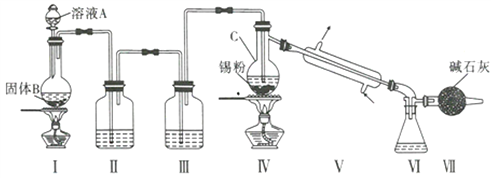
回答下列问题:
(1)Sn在元素周期表中的位罝为____________________________。
(2)II、III中的试剂分別为_______、__________;VII的作用是____________________、_____________。
(3)实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____________(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
(4)写出I中反应的化学方程式:_____________________________________。
(5)加热Sn粒之前要先让氯气充满整套装置,其目的是__________________________________。
(6)写出SnCl4水解的化学方程式:________________________________________。
(7)若IV中用去锡粉5.95g,反应后,VI中锥形瓶里收集到12.0gSnCl4,则SnCl4的产率为_____%。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
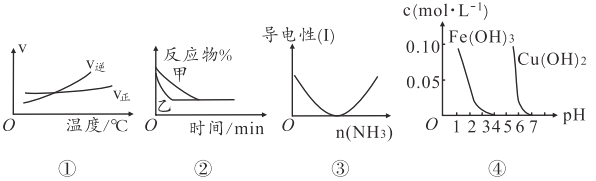
A. 根据图①可判断该可逆反应正反应为吸热反应
B. 若②表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,则乙对应的压强大
3C(g)+D(s)的影响,则乙对应的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,若除去CuSO4溶被中的Fe3+,可向溶液中加入适量CuO,调节pH至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种重要的化工原料,请回答下列问题:
I.高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀,请写出该反应的离子方程式__________________。
I1.实验室模拟下图所示流程制备亚硝酸钠:
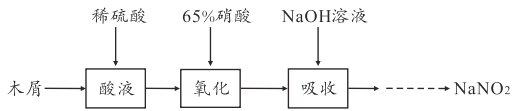
已知: ①氧化过程中,控制反应液温度在35~60℃条件下主要发生反应:
C6H12O6+ 12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
②氢氧化钠溶液吸收NO 和NO2发生反应:
NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O
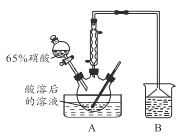
(1)木屑的主要成分是纤维素,结合已知信息①,你认为向木屑中加稀硫酸的作用是_____ ,氧化过程中反应温度不宜高于60℃,原因是______________。
(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,NO2-与另一种阴离子的物质的量之比为________。
(3)装置B用于制备NaNO2,盛裝的试剂除NaOH(aq)外,还可以是_____ (填字母)。
A.NaCl(aq) B.Na2CO3(aq) C.NaNO3( aq )
Ⅲ.测定产品纯度:
[实验步骤] ①准确称量ag 产品配成200mL溶液
②从步骤①配制的溶液中移取20.00mL 加入锥形瓶中
③用c mol/L酸性KMnO4溶液滴定至终点
④重复以上操作3 次,消耗酸性KMnO4溶液的平均体积为VmL
(1)锥形瓶中发生反应的离子方程式为____________。
(2)产品中NaNO2 的纯度为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com