


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、1 mol Na2O2固体中含离子总数为4NA |
| B、0.1mol铁粉与足量水蒸气反应生成的H2分子数为0.1NA |
| C、常温常压下,22.4L乙烯中C-H键数为4NA |
| D、等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,氧原子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
A、该反应的化学方程式为 CO+H2O
| |||
| B、该反应的焓变(△H)为正值 | |||
| C、升高温度,逆反应速率减小 | |||
| D、恒温恒容下,增大压强,H2 浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛的应用.图1表示一个电解池,
电解原理在化学工业中有广泛的应用.图1表示一个电解池,查看答案和解析>>
科目:高中化学 来源: 题型:
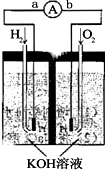 氢氧燃料电池是符合绿色化学理念的新型发电装置.
氢氧燃料电池是符合绿色化学理念的新型发电装置.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法不正确的( )
如图为根据电解原理制成“银电量计”.其原理是:通过测定电解过程中附着在惰性电极上金属质量,计算通过电解池的电量.下列说法不正确的( )| A、电量计工作时银棒应与电源的负极相连 |
| B、电量计工作时溶液里的阴离子向正极移动 |
| C、网袋是收集银溶解过程中产生的金属颗粒,若没有该网袋,测量结果会偏高 |
| D、若得金属银的沉积量为108.0mg,则电解过程中转移的电子数为0.001mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L SO3含有0.5NA SO3分子 |
| B、7.8g Na2O2与足量CO2反应,转移的电子数为0.1NA |
| C、1mol C5H12中含有的共价键数为17NA |
| D、1L 0.1mol?L-1的Na2S溶液中含有0.1NA S2-离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com