
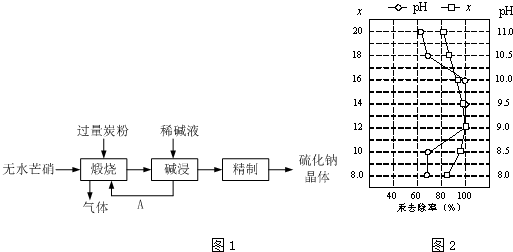
分析 根据图1可知,制备硫化钠晶体的流程为:无水芒硝(Na2SO4)与碳在高温煅烧反应:3Na2SO4+8C$\frac{\underline{\;高温\;}}{\;}$3Na2S+4CO2↑+4CO↑,由于硫离子水解,则用稀碱溶液浸泡抑制硫离子水解,通过精制获得硫化钠晶体,
(1)从获得固体A的原混合物状态分析操作方法,由于煅烧时加入过量的炭粉,且固体A可以分离并进行煅烧的应用分析A是什么物质;依据题干信息可知生成物中除含有硫化钠外还含有一氧化碳和二氧化碳,以及两种碳的氧化物分子个数比是1:1进行分析判断即可;
(2)依据硫化钠溶液中硫离子水解显碱性的水解平衡影响因素分析判断;
(3)常温时CuS、Cu(OH)2的Ksp,依据溶度积常数计算得到,依据溶液PH计算溶液中铜离子浓度,依据CuS的Ksp计算得到硫离子的浓度;
(4)①依据图象中曲线分析,汞去除率最佳PH和x的取值;
②依据硫化钠和次氯酸钠在溶液中发生的氧化还原反应电子守恒计算分析判断.
解答 解:(1)由于固体A是从液体中获得,所以得到A的操作是过滤,由于煅烧时加入过量的炭粉,且固体A可以分离并进行煅烧的应用可知A是炭粉,化学式为C;从题干信息可知生成物中除含有硫化钠外还含有一氧化碳和二氧化碳,而反应物是硫酸钠和碳,根据煅烧时一氧化碳和二氧化碳的分子个数比是1:1,所以可设两种气体的化学计量数分别是1和1,可得该反应的方程式为:$\frac{3}{4}$Na2SO4+2C $\frac{\underline{\;高温\;}}{\;}$$\frac{3}{4}$Na2S+1CO2↑+1CO↑,该反应两边同乘以4所得的反应方程式为:3Na2SO4+8C$\frac{\underline{\;高温\;}}{\;}$3Na2S+4CO2↑+4CO↑,
故答案为:过滤、干燥;3Na2SO4+8C$\frac{\underline{\;高温\;}}{\;}$3Na2S+4CO2↑+4CO↑;
(2)上述流程中采用稀碱液比用热水更好,硫化钠溶液中硫离子水解显碱性,水解过程是吸热反应,加热促进水解进行,稀碱溶液能起到抑制水解的作用,
故答案为:抑制;
(3)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌.若反应后测得溶液的pH=4,常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20,
Ksp=c(Cu2+)×c2(OH-)=2.2×10-20,pH=4,c(OH-)=10-10mol/L,c(Cu2+)=2.2mol/L,硫化铜中的Ksp=c(Cu2+)c(S2-)=8.8×10-36、计算得到c(S2-)=4×10-36mol/L,
故答案为:4×10-36;
(4)①依据图象中曲线分析,汞去除率最佳PH和x的取值是x=12,pH介于9~10之间时汞的去除率最大,接近100%,
故答案为:x=12、pH介于9~10之间;
②某毛纺厂废水中含0.001mol•L-1的硫化钠,与纸张漂白后的废水(含0.002mol•L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,次氯酸钠和硫化钠发生氧化还原反应,n(Na2S):n(NaClO)=0.001mol/L×1:0.002mol•L-1×2=1:4,依据电子守恒分析可知,Na2S+4NaClO=Na2SO4+4NaCl,处理后的废水中所含的主要阴离子有SO42-、Cl-,
故答案为:SO42-、Cl-.
点评 本题是物质制备的考查题,主要是化学方程式书写方法,溶度积常数的计算分析,氧化还原反应电子守恒的计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 两种物质反应,不管怎样书写化学方程式,平衡常数不变 | |
| B. | 某温度下,2L密闭容器中加入4mol A和2mol B发生反应: 3A(g)+2B(g)?4C(s)+2D(g).平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| C. | 温度一定时,当溶液中c(Ag+)•c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液 | |
| D. | 难溶电解质AB2饱和溶液中,c(A2+)=x mol•L-1,c(B-)=y mol•L-1,则Ksp值为4xy2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | N三N | N-H |
| 键能/(kJ•mol-1) | 436 | 945.6 | 391 |
| A. | +192.4 kJ•mol-1 | B. | +92.4kJ•mol-1 | C. | -92.4kJ•mol-1 | D. | -192.4kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
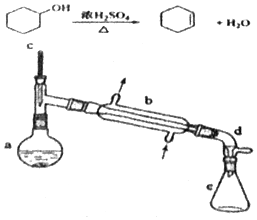 分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇 脱水是合成环己烯的常用方法,实验室合成坏己烯的反应和实验装置如图:
分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇 脱水是合成环己烯的常用方法,实验室合成坏己烯的反应和实验装置如图:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
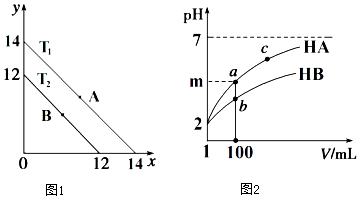 (1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.
(1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热为221KJ/mol | |
| B. | 稀盐酸与稀NaOH溶液反应生成1mol水,放出的热量57.3KJ | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热值为57.3KJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量57.3KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com