
下列说法正确的是( )
①漂白粉、水玻璃和铝热剂都是混合物;
②煤的干馏和石油的分馏都是化学变化;
③氨基酸、纯碱、芒硝和生石灰分别属于酸、碱、盐和氧化物;
④非极性键也可能存在于离子化合物中.
|
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ③④ |
| 混合物和纯净物;极性键和非极性键;煤的干馏和综合利用;氨基酸、蛋白质的结构和性质特点.. | |
| 分析: | ①从物质的组成角度分析,漂白粉的主要成分是氯化钙和次氯酸钙;水玻璃是硅酸钠的水溶液;铝热剂是铝和金属氧化物的混合物; ②从物质的性质和发生的反应判断,煤的干馏是在隔绝空气下加强热发生分解反应,是一种复杂的物理、化学变化,而石油的分馏是根据物质的沸点不同进行分离的,属于物理变化; ③纯碱是碳酸钠的俗称,是一种盐; ④非极性键也可能存在于离子化合物中,如过氧化钠属于离子化合物,其中含有非极性键. |
| 解答: | 解:①漂白粉的主要成分是氯化钙和次氯酸钙;水玻璃是硅酸钠的水溶液;铝热剂是铝和金属氧化物的混合物,以上三种物质都是混合物,故①正确; ②煤的干馏是在隔绝空气下加强热发生分解反应,是一种复杂的物理、化学变化,而石油的分馏是根据物质的沸点不同进行分离的,属于物理变化,故②错误; ③纯碱是碳酸钠的俗称,是一种强碱弱酸盐,水解呈碱性,故③错误; ④过氧化钠属于离子化合物,过氧根离子中O与O形成的化学键为非极性键,故④正确; 故选A. |
| 点评: | 本题考查较为综合,涉及物质的组成和分类、反应类型的判断、物质的分类、化学键等知识,题目难度不大,易错点为④,注意非极性键也可能存在于离子化合物中. |


科目:高中化学 来源: 题型:
经测定,H2O2为二元弱酸,其酸性比碳酸弱,它在碱性溶液中极不稳定,易分解生成H2O和O2。若向Na2O2中通入干燥的CO2气体,Na2O2与CO2并不起反应。
(1)写出H2O2在水溶液中的电离方程式
(2)用化学方程式表示Na2O2和潮湿的CO2气体反应的过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
请回答下列问题:
(1)T的原子结构示意图为 .
(2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 .
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 .
(5)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 .
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ.又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H= (注:题中所涉单质均为最稳定单质).

查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列反应:Co2O3 + 6HCl(浓) == 2CoCl2 + Cl2↑+ 3H2O (I)

(1)反应(I)中的氧化剂是
(2)根据反应(I)计算,若生成标准状况下33.6L氯气时,电子转移数目是
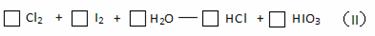 (3)将反应(II)配平
(3)将反应(II)配平
(4)反应(II) 中 发生氧化反应(5)HCl 、I2 、CoCl2三种物质的还原性由强到弱的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是( )
|
| A. | 标准状况下,40g SO3的体积为11.2L |
|
| B. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3 NA |
|
| C. | 5NH4NO3 |
|
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
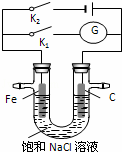
|
| A. | K1闭合,铁棒上发生的反应为2H++2e﹣→H2↑ |
|
| B. | K1闭合,石墨棒周围溶液pH逐渐升高 |
|
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
|
| D. | K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等.水垢会形成安全隐患,需及时清洗除去.清洗流程如下:
Ⅰ.加入NaOH 和 Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉.
(资料在线:K3[Fe(CN)6]溶液遇亚铁盐会生成蓝色沉淀.)
(1)用NaOH溶解二氧化硅的化学方程式是 .
(2)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有 .
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因 .
(3)步骤Ⅲ中,加入Na2SO3的目的是 .
(4)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
Fe+ NO2+ H2O═ N2↑+ +
②钝化效果的检测一般可用滤纸浸渍配好的检测液后贴附于待测样品表面或直接将溶液涂、滴于待测表面.下面检测钝化效果的方法合理的是 .
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
d.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验对应的结论不正确的是
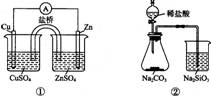
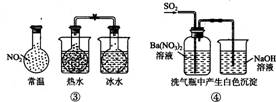
A.①能组成Zn-Cu原电池 B.②能证明非金属性Cl>C>Si
C.③能说明2NO2 N2O4 △H<0 D.④中自色沉淀为BaSO4
N2O4 △H<0 D.④中自色沉淀为BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应所得溶液中一定只含一种溶质的是
A.向NaOH溶液中通入CO2 B.向Ca(OH)2溶液中通入Cl2
C.向蒸馏水中加入少量金属Na D.向MgSO4溶液中滴入NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com