
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
X的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同
Y元素的族序数是周期序数的三倍
Z元素的电负性在所有元素中最大
W原子的第一至第六电离能分别为:I1=578KJ•mol﹣1,I2=1817KJ•mol﹣1,I3=2745KJ•mol﹣1,I4=11575KJ•mol﹣1,I5=14830KJ•mol﹣1,I6=18376KJ•mol﹣1
Q为前四周期中电负性最小的元素
R原子最高能层上只有1个单电子,其余各能层均已充满电子.
请回答:
(1)R在周期表中位于 区,写出R基态原子的价电子排布式 .
(2)X与Y形成的二元化合物中属于非极性分子的 (用化学式表示).
(3)写出Z元素的单质与水反应的方式 ,此反应中氧化剂与氧化产物物质的量之比为 .
(4)X的氯化物的熔点比Q的氯化物的熔点 (“高”或“低”),理由是 .
(5)光谱证实单质W与强碱性溶液反应有[W(OH)4]﹣生成,则中[W(OH)4]﹣﹣存在 (填选项字母)
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键
(6)金刚砂(SiC)的结构与金刚石(4个碳原子在立方体体内,其余碳原子分别位于面心和顶角)相似,硬度与金刚石相当,则金刚砂的晶胞中含有 个硅原子, 个碳原子,其中硅原子的杂化方式为 .
考点: 位置结构性质的相互关系应用.
分析: X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大,X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,则核外电子排布为1s22s22p2,则X为C元素;Y元素的族序数是其周期数的三倍,原子只能有2个电子层,最外层电子数为6,则Y为O元素;Z元素的电负性在所有元素中最大,则Z为F元素;Q为前四周期中电负性最小的元素,则Q为钾元素;W原子的第四电离能剧增,表现+3价,原子序数小于K,则W为Al元素;R处于第四周期,R原子最高能层上只有1个单电子,其余各能层均已充满电子,原子核外电子数为2+8+18+1=29,故R为Cu,据此解答.
解答: 解:X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大,X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同,则核外电子排布为1s22s22p2,则X为C元素;Y元素的族序数是其周期数的三倍,原子只能有2个电子层,最外层电子数为6,则Y为O元素;Z元素的电负性在所有元素中最大,则Z为F元素;Q为前四周期中电负性最小的元素,则Q为钾元素;W原子的第四电离能剧增,表现+3价,原子序数小于K,则W为Al元素;R处于第四周期,R原子最高能层上只有1个单电子,其余各能层均已充满电子,原子核外电子数为2+8+18+1=29,故R为Cu.
(1)R为Cu,处于周期表中第四周期第IB族,属于ds区元素,基态原子的价电子排布式为3d104s1,
故答案为:ds;3d104s1;
(2)X与Y形成的二元化合物由CO、CO2,属于非极性分子的是CO2,
故答案为:CO2;
(3)Z元素的单质与水反应的方式为:2F2+2H2O=4HF+O2,此反应中氧化剂为F2,氧化产物为O2,氧化剂与氧化产物物质的量之比为2:1,
故答案为:2F2+2H2O=4HF+O2;2:1;
(4)X的氯化物为CCl4,属于分子晶体,Q的氯化物为KCl,属于离子晶体,故熔点CCl4<KCl,
故答案为:低;CCl4属于分子晶体,KCl属于离子晶体;
(5)[Al(OH)4]﹣中氢原子和氧原子之间存在极性共价键,为σ键,铝原子含有空轨道,氧原子含有孤电子对,所以该离子中含有配位键,
故答案为:acd;
(6)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有硅原子个数=4+8×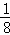 +6×
+6×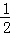 =4,金刚砂中碳原子和硅原子个数之比为1:1,所以该晶胞中碳原子个数是4,每个硅原子连接4个C﹣Si键,所以硅原子的杂化方式为sp3,
=4,金刚砂中碳原子和硅原子个数之比为1:1,所以该晶胞中碳原子个数是4,每个硅原子连接4个C﹣Si键,所以硅原子的杂化方式为sp3,
故答案为:4;4;sp3.
点评: 本题考查结构性质位置关系、核外电子排布规律、化学键、晶胞结构及计算等,难度中等,推断元素是解题关键,注意利用均摊法进行晶胞的有关计算.


科目:高中化学 来源: 题型:
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ.电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
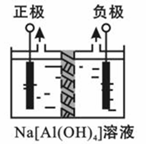
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e-时,将制得__________mol的Al(OH)3。
Ⅱ.制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_________m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是____________________。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中与物质化学性质无关的是( )
A. 用铂丝蘸取Na2CO3溶液在酒精灯焰上灼烧,观察到黄色火焰
B. 明矾可用作净水剂
C. 木条蘸取浓硫酸后变黑色
D. 用水(滴加了酚酞试液)和氨气做喷泉实验
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A. 铁和足量稀硝酸反应:Fe+2H+═Fe2++H2↑
B. 碳酸钙和稀硝酸反应:CaCO3+2H+═Ca2++H2O+CO2↑
C. 稀硫酸和Ba(OH)2溶液反应:Ba2++H++SO42﹣+OH﹣═BaSO4↓+H2O
D. Cl2和FeCl2溶液反应:Cl2+Fe2+═Fe3++2Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
学生甲和学生乙完成了下列实验,其中实验现象完全相同的是( )
学生甲 学生乙
A 向碳酸氢钠溶液中逐渐加入盐酸 向盐酸中逐滴加入碳酸氢钠溶液
B 向氯化亚铁溶液中滴加KSCN溶液,再通入氯气 向氯化亚铁溶液中通入氯气,再滴加KSCN溶液
C 向三氯化铝溶液中滴加氢氧化钠溶液 向氢氧化钠溶液中滴加入三氯化铝溶液
D 向BaCl2溶液中通入二氧化硫 向BaCl2溶液中通入SO3
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 自然界中含有大量游离态的硅,纯净的硅晶体可用于制作计算机芯片
B. Si、P、S、Cl相应的氧化物对应水化物的酸性依次增强
C. 工业上通常用电解熔融氧化铝制得金属铝
D. 金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步发生
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式次氯酸镁[BMH化学式为Mg2ClO(OH)3•H2O]难溶于水,相对稳定,是一种有开发价值的无机抗菌剂.某研发小组通过下列流程制备碱式次氯酸镁:
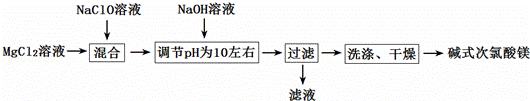
(1)在上述流程中,“过滤”操作用到的硅酸盐材质的仪器有
(2)NaClO的电子式为 ,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标.次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,则生成氯气的离子方程式为
(4)就抗菌和杀菌效果而言,氯制剂具有广谱、高效的特点,像BMH这样难溶又稳定的氯制剂几乎别无他物.在酸性溶液中BMH具有杀菌、漂白作用的原因是 (用离子方程式表示)
(5)在混合溶液中加入NaOH溶液并调节pH在10左右,即生成BMH,其化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应既属于非氧化还原反应,又是吸热反应的是( )
A.铝片和稀硫酸反应 B.Ba(OH)2•8H2O与NH4Cl反应
C.灼热的碳与二氧化碳反应 D.甲烷在氧气中燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com