
 (1)基态硒原子的价层电子排布式为4s24p4.
(1)基态硒原子的价层电子排布式为4s24p4.分析 (1)硒为34号元素,有6个价电子,据此书写价层电子排布式;
(2)同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素;同主族,从上到下,元素的第一电离逐渐减小;含氧酸分子中非羟基氧越多,酸性越强;
(3)根据中心原子的价层电子对数可判断杂化方式及微粒的立体构型;
(4)H2Se分子中有孤电子对,据此判断分子的极性;根据晶体的性质可判断晶体的类型;
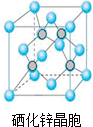
(5)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,该晶胞中含有硒原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有锌原子数为4,根据ρ=$\frac{m}{V}$可计算出晶胞的体积,进而确定晶胞的边长;
解答 解:(1)硒为34号元素,有6个价电子,所以硒的价层电子排布式为4s24p4,
故答案为:4s24p4;
(2)同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素,所以Ge、As、Se三种元素的第一电离能的大小顺序是:As>Se>Ge,含氧酸分子中非羟基氧越多,酸性越强,H2SeO4分了中非羟基氧数大于H2SeO3,所以H2SeO4的酸性比H2SeO3的强,
故答案为:As>Se>Ge;H2SeO4分了中非羟基氧数大于H2SeO3;
(3)H2SeO3的中心原子的价层电子对数为$\frac{6+2}{2}$=4,所以Se杂化方式为sp3杂化,SeO32-的中心原子Se的价层电子对数为$\frac{6+2}{2}$=4,离子中有一个孤电子对,所以SeO32-的立体构型是 三角锥形,
故答案为:sp3; 三角锥形;
(4)H2Se分子中有孤电子对,所以H2Se属于 极性分子,单质硒的熔点为217℃,比较小,所以它属于分子晶体,
故答案为:极性;分子;
(5)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,所以硒原子的配位数为4,该晶胞中含有硒原子数为该晶胞中含有硒原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有锌原子数为4,根据ρ=$\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{V}$,所以V=$\frac{4M}{ρ{N}_{A}}$,则晶胞的边长为$\root{3}{\frac{4M}{ρ{N}_{A}}}$cm=$\root{3}{\frac{4M}{ρ{N}_{A}}}$×1010pm,
故答案为:4;$\root{3}{\frac{4M}{ρ{N}_{A}}}$×1010pm.
点评 本题考查了价电子排布、原子轨道的杂化、等电子体、分子的极性、分子的空间构型、晶胞的计算等知识,注意把握微粒空间构型的判断方法,侧重对学生综合能力的考查,题目难度中等.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | 该物质是有机物 | B. | 该分子中含有9个σ键和10个π键 | ||
| C. | 该分子可发生加成反应 | D. | 该分子中所有原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
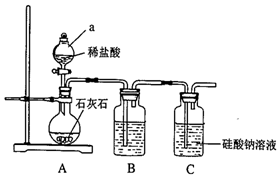 某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如图:
某校化学兴趣小组拟探究碳、硅元素的非金属性的相对强弱,实验装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
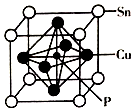 磷化铜(Cu3P2)用于制造磷青铜、磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件.
磷化铜(Cu3P2)用于制造磷青铜、磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.
A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、③无支链,且分子中碳原子共直线 | B. | 沸点比较:⑤>④>③>②>① | ||
| C. | ①、②、③互为同系物 | D. | ③、④、⑤互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验目的 | |
| A | 灼烧白色粉末,火焰呈黄色 | 证明原粉末中有Na+,无K+ |
| B | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 | 证明该Fe(NO3)2试样已经变质 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | 证明Br-还原性强于Cl- |
| D | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 证明溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为倡导“低碳”,减小CO2对环境的影响,需对CO2进行创新利用研究.T1℃使,将将9mol CO2和12mol H2充入3L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p0.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示.下列说法错误的是( )
为倡导“低碳”,减小CO2对环境的影响,需对CO2进行创新利用研究.T1℃使,将将9mol CO2和12mol H2充入3L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p0.改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示.下列说法错误的是( )| A. | 曲线Ⅱ对应的条件改变是增大压强 | |
| B. | T2℃时,上述反应平衡常数为0.52,则T2>T1 | |
| C. | 在T1℃,若起始时向容器充入4.5 mol CO2、6 mol H2,平衡时容器内压强P1>$\frac{{P}_{0}}{2}$ | |
| D. | 在T1℃,若起始时向容器中充入4.5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com