
【题目】完成下列各题。
(1)NaHCO3是制作糕点的常用疏松剂,写出NaHCO3受热分解的化学方程式__________________。
(2)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,请用化学方程式表示该反应的原理:__________________________________。
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C是所在周期原子半径最大的主族元素,A和B、D、E均能形成共价型化合物。A和B、C和E形成的化合物在水中均呈碱性.回答下列问题:
(1)元素D在周期表中的位置____________,其氢化物的结构式是___________;
(2)B、C、E三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)___________;
(3)A分别与B、E形成的化合物可以相互反应,写出生成的正盐的电子式_____________;
(4)A、B和E个数比为5:1:1形成的化合物中存在的化学键类型为___________,其与足量的氢氧化钠溶液反应的离子方程式为______________________________;
(5)C和E形成的化合物在水中呈碱性的原因(用离子方程式表示)是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
A. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1
B. 2 min后,向容器中再通入一定量的SO3气体,重新达到平衡时,SO2的含量降低
C. 若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO3)大于1.4 mol
D. 若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
① 写出放电时负极的电极反应式:______________________________;
② 铅蓄电池放电时,溶液的pH将_________(填增大、减小或不变)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
③ 放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
(2)下图是某宇宙飞船中使用的氢氧燃料电池。其导电介质为KOH,总反应为:2H2 + O2=2H2O。
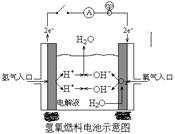
① 则负极通入的是_______,(填“H2”或“O2”)负极电极反应式为:_______________________,正极电极反应式为:______________________。
②如把导电介质改为稀H2SO4,则电极反应式为:负极__________________,正极______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C(s)+ ![]() O2(g)═CO(g);△H=﹣110.5kJmol﹣1
O2(g)═CO(g);△H=﹣110.5kJmol﹣1
②C(s)+O2(g)═CO2(g);△H=﹣393.51kJmol﹣1
则反应C(s)+CO2(g)═2CO(g)的△H为( )
A.﹣283.01 kJmol﹣1
B.+172.51 kJmol﹣1
C.+283.01 kJmol﹣1
D.﹣172.51 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过下列两步实验测定草酸晶体(H2C2O4·xH2O)中结晶水x的值:
①称取2.52 g草酸晶体,配制成100 .00 mL溶液。
②取25.00 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为0.100 mol·L-1 KMnO4溶液进行滴定。其反应原理是:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
请回答下列问题:
(1)实验②中,KMnO4应装在______滴定管中(填“酸式”、“碱式”)。
(2)如图表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积______。
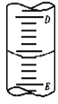
A.是amL B.是(50-a)mL
C.一定大于amL D.一定大于(50-a)mL
(3)判断达到滴定终点的现象是_____________________________;
若滴定终点时,共用去KMnO4溶液20.00 mL,则x =__________。
(4)若在滴入KMnO4溶液之前滴定管的尖嘴部分有气泡,滴定结束后气泡消失,则会使测定结果______(偏高、偏低或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水作为反应物参加的反应中:①钠与水反应 ②Na2O2与水反应 ③氟气与水反应 ④电解水。按照水的作用依次是只作氧化剂、只作还原剂、既作氧化剂又作还原剂、既不作氧化剂又不作还原剂顺序排列是
A.①②③④B.①③④②C.①④②③D.①④③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HBr被O2氧化依次由如下Ⅰ、Ⅱ、Ⅲ、三步反应组成,1molHBr被氧化为Br2放出12.67kJ热量,其能量与反应进程曲线如图所示。
(Ⅰ)HBr(g)+O2(g)==HOOBr(g)
(Ⅱ)HOOBr(g)+ HBr(g)==2HOBr(g)
(Ⅲ)HOBr(g)+ HBr(g)== H2O(g)+ Br2(g)
下列说法正确的是

A. 三步反应均为放热反应
B. 步骤(I)的反应速率最慢
C. HOOBr比HBr和O2稳定
D. 热化学方程式为4HBr(g)+O2(g)==2H2O(g)+2Br2(g) △H=-12.675kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com