
| A. | 只含离子键的化合物才是离子晶体 | |
| B. | (NH4)2SO4晶体是含有离子建、共价键和配位键的分子晶体 | |
| C. | 由于I-I中的共价键键比F-F、Cl-Cl、Br-Br都弱,因此在卤素单质中I2的熔点、沸点最低 | |
| D. | 分子晶体中一定不存在离子键,而离子晶体中可能存在共价键 |
分析 A.离子化合物中一定含离子键;
B.硫酸铵中含有离子键、极性共价键和配位键;
C.分子晶体的熔沸点与相对分子质量成正比;
D.分子晶体中一定不含离子键,含有离子键的晶体属于离子晶体.
解答 解:A.离子化合物中一定含离子键,可能还含共价键,故A错误;
B.硫酸铵中铵根离子和硫酸根离子之间存在离子键,氮原子和氢原子之间存在共价键和配位键,属于离子晶体,故B错误;
C.分子晶体的熔沸点与相对分子质量成正比,碘分子的相对分子质量比氟气、氯气和溴的大,所以其熔沸点最高,故C错误;
D.分子晶体中一定不含离子键,含有离子键的晶体属于离子晶体,离子晶体中可能含有共价键,如NaOH属于离子晶体,含有共价键,故D正确;
故选D.
点评 本题考查化学键与化合物的类型,注意利用实例分析选项,把握特殊物质中的化学键及稀有气体中不含化学键,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:填空题
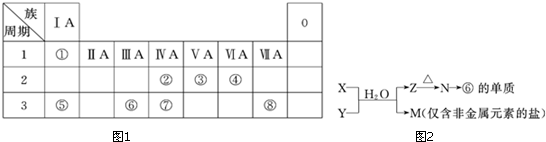
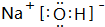 .
.| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH═Na2SO3+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
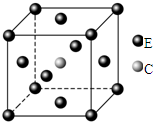 原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:
原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn-2e-=Zn2+ | B. | Br2+2e-=2Br- | C. | 2Br--2e-=Br2 | D. | Zn2++2e-=Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>H2O>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X:它的原子中第三电子层比第二电子层少2个电子 | |
| B. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| C. | 元素Z:位于元素周期表中的第3周期,ⅢA族 | |
| D. | 元素W:它的单质硬度最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.| 实验步骤 | 实验现象 | 结论与化学反应方程式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com