
(12分) 工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。
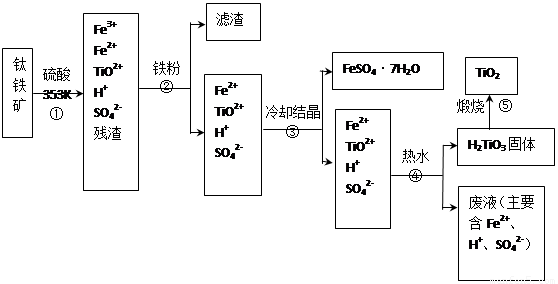
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。a. 熔沸点差异 b. 溶解性差异 c. 氧化性、还原性差异
(3)步骤②、③、④中,均需用到操作是 (填操作名称)。
(4)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),则反应的离子方程式为 。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
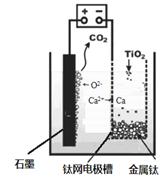
①写出阳极所发生反应的电极反应式: 。
②在制备金属钛前后,CaO的总量不变,其原因是
(请结合化学用语解释)
(1)2Fe3+ + Fe =3Fe2+ (2分)(2)b (1分)(3)过滤(1分)
(4)MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O(2分)
(5)① 2O2- - 4e- = O2↑或 C + 2O2- - 4e- = CO2↑(2分)
②制备TiO2时,在电解槽发生如下反应:2CaO  2Ca + O2↑, 2Ca + TiO2 =Ti + 2CaO,由此可见,CaO的量不变。或:
制备TiO2时,在电解槽发生如下反应:
2Ca + O2↑, 2Ca + TiO2 =Ti + 2CaO,由此可见,CaO的量不变。或:
制备TiO2时,在电解槽发生如下反应:
阴极:2Ca2+ + 4e- = 2Ca
阳极:2O2- - 4e- = O2↑
2Ca + TiO2 = Ti + 2CaO,由此可见,CaO的量不变。(2分)
【解析】(1)铁离子能把铁单质氧化生成亚铁离子,方程式为2Fe3+ + Fe =3Fe2+ 。
(2)冷却结晶,有固体析出,因此是利用了物质溶解性的差异,答案选b。
(3)根据流程图可知,三次实验中均产生不溶性物质,所以都需要过滤。
(4)二氧化锰具有氧化性,能氧化废液中的亚铁离子,方程式为MnO2 + 2Fe2+ + 4H+ = Mn2+ + 2Fe3+ + 2H2O。
(5)①电解池中阳极失去电子,所以根据熔融体中的离子可知,应该是氧离子失去电子,即 2O2- - 4e- = O2↑或 C + 2O2- - 4e- = CO2↑。
②由于制备TiO2时,在电解槽发生如下反应:2CaO  2Ca + O2↑, 2Ca + TiO2 =Ti + 2CaO,所以CaO的量不变。
2Ca + O2↑, 2Ca + TiO2 =Ti + 2CaO,所以CaO的量不变。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
(12分) 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)原子序数为22基态钛原子的核外电子排布式为 。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于
晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 。
A. SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42- 稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ,原因是 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ,分子的空间构型为 。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3、SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是 。
(2)沉淀M中除含有泥沙外,一定还含有 ,固体N是 。
(3)滤液X中,含铝元素的溶质的化学式为 ,它属于 (选填“酸”、“碱” 或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入 (选填“氨水”或NaOH溶液)来制取Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2010年江苏省扬州市高三第四次模拟考试化学试题 题型:填空题
(A)(12分)工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)基态钛原子的核外电子排布式为 ▲ 。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于 ▲ 晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 ▲ 。
A.SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ▲ ,原因是 ▲ 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ▲ ,分子的空间构型为 ▲ 。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 ▲ 。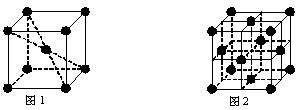
查看答案和解析>>
科目:高中化学 来源:2010年江苏省高二下学期期末考试化学 题型:计算题
(12分) 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)原子序数为22基态钛原子的核外电子排布式为 。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于
晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 。
A. SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42- 稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ,原因是 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ,分子的空间构型为 。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 。

查看答案和解析>>
科目:高中化学 来源:2010年江苏省扬州市高三第四次模拟考试化学试题 题型:填空题
(A)(12分) 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)基态钛原子的核外电子排布式为 ▲ 。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于 ▲ 晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 ▲ 。
A.SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42- 稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ▲ ,原因是 ▲ 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ▲ ,分子的空间构型为 ▲ 。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 ▲ 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com