

·ÖĪö øĆŹµŃéŌĄķĪŖ£ŗmgøĆÖÖ°±»łĖį·ÅŌŚ“æŃõÖŠ³ä·ÖČ¼ÉÕ£¬Éś³ÉCO2”¢H2OŗĶN2£®×°ÖĆBÄŚŹ¢·ÅÅØĮņĖį£¬ĪüŹÕÉś³ÉµÄĖ®£¬øł¾Ż×°ÖĆBŌöÖŲ£¬Č·¶ØmgøĆÖÖ°±»łĖįÖŠŗ¬ĒāŌŖĖŲÖŹĮ棬øł¾ŻFÖŠĖ®µÄĢå»żČ·¶ØµŖĘųµÄĢå»ż£¬²¢ÓÉ“ĖČ·¶Ø“ż²ā°±»łĖįÖŠŗ¬ÓŠµÄµŖŌŖĖŲµÄÖŹĮ棬ŌŚ¼ĘĖćŃõŌŖĖŲµÄÖŹĮæ£¬Č·¶Ø·Ö×ÓÖŠŌŖĖŲŌ×ÓøöŹż±Č£¬ÓÉ“ĖČ·¶Ø×ī¼ņŹ½£¬
£Ø1£©ĄūÓĆÅÅĖ®·Ø²ā¶ØµŖĘųµÄĢå»ż£¬Č·¶ØmgøĆÖÖ°±»łĖįÖŠŗ¬µŖŌŖĖŲÖŹĮ棻
£Ø2£©°±»łĖįŗĶŃõĘųµÄ·“Ó¦£¬ŅŌ¼°ĶĶųŗĶŃõĘųµÄ·“Ó¦¶¼ŠčŅŖ¼ÓČČ£»
£Ø3£©°±»łĖį·ÅŌŚ“æŃõÖŠ³ä·ÖČ¼ÉÕ£¬Éś³É¶žŃõ»ÆĢ¼”¢Ė®ŗĶµŖĘų£»
£Ø4£©ÓÉŌĄķæÉÖŖ£¬ĶĶųĪüŹÕĪ“·“Ó¦µÄO2£»
£Ø5£©øł¾Ż¶ĮŹżŹ±±ŲŠė±£Ö¤Ń¹ĒæĻąĶ¬½ųŠŠ·ÖĪö£»
£Ø6£©øĆŌĄķæÉÖŖ£¬²ā³öøĆÖÖ°±»łĖį·Ö×ÓŹ½ŠčŅŖ¶žŃõ»ÆĢ¼”¢Ė®µÄÖŹĮæŅŌ¼°µŖĘųµÄĢå»ż£¬¼ĘĖćŃõŌŖĖŲµÄÖŹĮæ£¬Č·¶Ø·Ö×ÓÖŠŌŖĖŲŌ×ÓøöŹż±Č£¬ŌŁ½įŗĻ°±»łĖįµÄĻą¶Ō·Ö×ÓÖŹĮæČ·¶Ø·Ö×ÓŹ½£®
½ā“š ½ā£ŗŹ×ĻČ¹Ū²ģ×°ÖĆĶ¼£¬ŗÜČŻŅ×擳öŌŚAÖŠŹĒ°±»łĖįµÄČ¼ÉÕ£¬ŌŚBÖŠŹĒĪüŹÕÉś³ÉµÄĖ®£¬ŌŚCÖŠŹĒĪüŹÕ²śÉśµÄ¶žŃõ»ÆĢ¼£¬DµÄÉč¼ĘŹĒ³żµō¶ąÓąµÄŃõĘų£¬EŗĶFµÄÉč¼ĘÄæµÄŹĒĶعżĮæĘųµÄ·½Ź½²āĮæµŖĘųµÄĢå»ż£®ŌŚÕāøö»ł“”ÉĻ£¬øł¾Ż±¾ŹµŃéµÄÄæµÄŹĒ²ā¶ØijÖÖ°±»łĖį£ØCxHyOzNp£©µÄ·Ö×Ó×é³É£¬ŠčŅŖ²āĮæµÄŹĒ¶žŃõ»ÆĢ¼”¢Ė®ŗĶµŖĘųµÄĮ棬ÕāČżøöĮææÉŅŌČ·¶Ø°±»łĖįµÄŹµŃéŹ½£¬ĖłŅŌŌŁ¼ÓÉĻ°±»łĖįµÄĻą¶Ō·Ö×ÓÖŹĮæ¾ĶæÉŅŌČ·¶Ø°±»łĖįµÄ·Ö×ÓŹ½£®øł¾ŻÕāøöŌĄķ£¬ŹµŃéµÄ×¼Č·ŠŌČ”¾öÓŚ¶žŃõ»ÆĢ¼”¢Ė®ŗĶµŖĘųµÄĮæµÄ²āĮ棬¶ųĒŅ¹Ų¼üŹĒµŖĘųµÄĮæµÄ²āĮ棬¶ŌµŖĘųĮæµÄ²āĮæ×īæÉÄܲśÉśÓ°ĻģµÄ¾ĶŹĒŌ×°ÖĆÖŠµÄµŖĘųŗĶ¹żĮæµÄŃõĘų£¬ĖłŅŌŅ»æŖŹ¼¾ĶÓ¦øĆĻČĶØŃõĘų½«Ō×°ÖĆÖŠæÕĘųÅž”£¬¶ųŌŚ²āĮæµŖĘųĒ°£¬½«¹żĮæµÄŃõĘųÅž”£»øĆŹµŃéŌĄķĪŖ£ŗmgøĆÖÖ°±»łĖį·ÅŌŚ“æŃõÖŠ³ä·ÖČ¼ÉÕ£¬Éś³ÉCO2”¢H2OŗĶN2£®×°ÖĆBÄŚŹ¢·ÅÅØĮņĖį£¬ĪüŹÕÉś³ÉµÄĖ®£¬øł¾Ż×°ÖĆBŌöÖŲ£¬Č·¶ØmgøĆÖÖ°±»łĖįÖŠŗ¬ĒāŌŖĖŲÖŹĮ棬øł¾ŻFÖŠĖ®µÄĢå»żČ·¶ØµŖĘųµÄĢå»ż£¬²¢ÓÉ“ĖČ·¶Ø“ż²ā°±»łĖįÖŠŗ¬ÓŠµÄµŖŌŖĖŲµÄÖŹĮ棬ŌŚ¼ĘĖćŃõŌŖĖŲµÄÖŹĮæ£¬Č·¶Ø·Ö×ÓÖŠŌŖĖŲŌ×ÓøöŹż±Č£¬ÓÉ“ĖČ·¶Ø×ī¼ņŹ½£®
£Ø1£©×°ÖƵÄæÕĘųÖŠŗ¬ÓŠN2£¬Ó°ĻģÉś³ÉµŖĘųµÄĢå»ż²ā¶Ø£¬Šč½«×°ÖĆÖŠµÄN2Åž»£¬±ÜĆā²ŠĮōŌŚ×°ÖĆÖŠµÄæÕĘų¶ŌŹµŃé½į¹ū²śÉśÓ°Ļģ£¬
¹Ź“š°øĪŖ£ŗ½«×°ÖĆÖŠµÄN2Åž»£¬±ÜĆā²ŠĮōŌŚ×°ÖĆÖŠµÄæÕĘų¶ŌŹµŃé½į¹ū²śÉśÓ°Ļģ£»
£Ø2£©°±»łĖįŗĶŃõĘųµÄ·“Ó¦£¬ŅŌ¼°ĶĶųŗĶŃõĘųµÄ·“Ó¦¶¼ŠčŅŖ¼ÓČČ£¬Ó¦ĻȵćČ¼D“¦µÄ¾Ę¾«µĘ£¬ĪüŹÕĪ“·“Ó¦µÄŃõĘų£¬±£Ö¤×īÖÕŹÕ¼ÆµÄĘųĢåĪŖN2£¬
¹Ź“š°øĪŖ£ŗAD£»D£»
£Ø3£©£©°±»łĖį·ÅŌŚ“æŃõÖŠ³ä·ÖČ¼ÉÕ£¬Éś³É¶žŃõ»ÆĢ¼”¢Ė®ŗĶµŖĘų£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ£ŗCxHyOzNm+£Øx+$\frac{y}{4}$-$\frac{z}{2}$£©O2$\stackrel{µćČ¼}{”ś}$xCO2+$\frac{y}{2}$H2O+$\frac{p}{2}$N2£¬
¹Ź“š°øĪŖ£ŗCxHyOzNm+£Øx+$\frac{y}{4}$-$\frac{z}{2}$£©O2$\stackrel{µćČ¼}{”ś}$xCO2+$\frac{y}{2}$H2O+$\frac{p}{2}$N2£»
£Ø4£©ÓÉŌĄķæÉÖŖ£¬ĶĶųĪüŹÕĪ“·“Ó¦µÄŃõĘų£¬±£Ö¤×īÖÕŹÕ¼ÆµÄĘųĢåĪŖN2£¬
¹Ź“š°øĪŖ£ŗĪüŹÕĪ“·“Ó¦µÄŃõĘų£¬±£Ö¤×īÖÕŹÕ¼ÆµÄĘųĢåĪŖN2£»
£Ø5£©¶ĮŹżŹ±±ŲŠė±£Ö¤Ń¹ĒæĻąĶ¬£¬ĖłŅŌ×¢ŅāŹĀĻī£ŗ¢ŁĄäČ“ÖĮŹŅĪĀ£¬¢Śµ÷½ŚĮæĶ²øß¶Č£¬Ź¹E”¢FÖŠŅŗĆęø߶ČŅ»ÖĀ£¬¢Ū¶ĮŹżŹ±£¬ŹÓĻßÓė°¼ŅŗĆę×īµĶµćĻąĘ½£¬
¹Ź“š°øĪŖ£ŗ¢ŁĄäČ“ÖĮŹŅĪĀ£¬¢Śµ÷½ŚĮæĶ²øß¶Č£¬Ź¹E”¢FÖŠŅŗĆęø߶ČŅ»ÖĀ£¬¢Ū¶ĮŹżŹ±£¬ŹÓĻßÓė°¼ŅŗĆę×īµĶµćĻąĘ½£»
£Ø6£©øĆŌĄķæÉÖŖ£¬²ā³öøĆÖÖ°±»łĖį·Ö×ÓŹ½ŠčŅŖ¶žŃõ»ÆĢ¼”¢Ė®µÄÖŹĮæŅŌ¼°µŖĘųµÄĢå»ż£¬ŌņŠčŅŖ²ā¶ØB”¢CĮ½×°ÖƵÄŌöÖŲĮ棬
¹Ź“š°øĪŖ£ŗB”¢CĮ½×°ÖƵÄŌöÖŲĮ森
µćĘĄ ±¾Ģāæ¼²éѧɜĄūÓĆČ¼ÉÕ·ØČ·¶ØÓŠ»śĪļ·Ö×Ó×é³ÉµÄÖŖŹ¶£¬ĢāÄæÄѶČÖŠµČ£¬øł¾ŻŌ×ÓŹŲŗć·ØĄ“½ā“š£¬Ąķ½āŹµŃéŌĄķĪŖ½ā“š¹Ų¼ü£¬ŹŌĢāÅąŃųĮĖѧɜµÄ·ÖĪöÄÜĮ¦¼°×ŪŗĻÓ¦ÓĆÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µķ·ŪŗĶĻĖĪ¬ĖŲ | B£® | ¼×ĶéŗĶŅŅĶé | C£® | ÕįĢĒŗĶĀóŃæĢĒ | D£® | 12CŗĶ14C |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ZµÄŃõ»ÆĪļŹōÓŚ¼īŠŌŃõ»ÆĪļ | |
| B£® | Ō×Ó°ė¾¶£ŗr£ØY£©£¼r£ØW£©£¼r£ØZ£© | |
| C£® | WµÄ¼ņµ„ĘųĢ¬Ēā»ÆĪļµÄČČĪČ¶ØŠŌ±ČYµÄĒæ | |
| D£® | WµÄŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļŅ»¶ØŹĒĒæĖį |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ś¢Ū¢Ż | B£® | ¢Ł¢Ś¢Ü | C£® | ¢Ł¢Ū¢Ü | D£® | ¢Ū¢Ü¢Ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
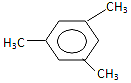 ÓĆĻµĶ³ĆüĆū·ØĆüĆūµÄĆū³ĘĪŖ£Ø””””£©
ÓĆĻµĶ³ĆüĆū·ØĆüĆūµÄĆū³ĘĪŖ£Ø””””£©| A£® | ¼äČż¼×±½ | B£® | 1£¬3£¬5-Čż¼×±½ | C£® | Čż¼×±½ | D£® | 1-3-5£¬Čż¼×±½ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | a=b | B£® | 2a=b | C£® | 4a=3b | D£® | 2a=3b |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £¬
£¬
 Ӣ
”¢ £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øĆ·ÖÉ¢ĻµµÄ·ÖÉ¢ÖŹĪŖFe2O3 | |
| B£® | æÉÓĆ¹żĀĖµÄ·½·Ø½«ŗŚÉ«½šŹōŃõ»ÆĪļÓėNa+·ÖĄėæŖ | |
| C£® | Ļņ·ŠĖ®ÖŠÖšµĪµĪ¼Ó0.1 mol/L FeCl3ČÜŅŗŅ²æɵƵ½Fe£ØOH£©3½ŗĢå | |
| D£® | ¼ÓČėNaOHČÜŅŗŹ±·¢ÉśµÄ·“Ó¦æÉÄÜĪŖ£ŗFe2++2Fe3++8OH-ØTFe3O4+4H2O |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com