
 (1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.
(1)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层.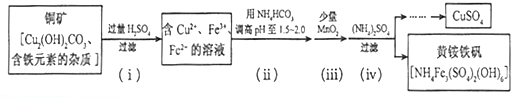
分析 (1)①要把铜从铜盐中置换铜出来,比如用铁就可以,铁是作还原剂的,所以加入还原剂;
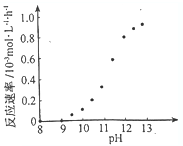
②根据图示信息,pH=8-9之间,反应速率为0,所以要使反应停止,调节溶液的pH至8-9 之间;
(2)①加入的碳酸氢铵目的是调高pH,碳酸氢根离子能与溶液中氢离子反应;
②由题意可知,亚铁离子变成了铁离子,1mol MnO2转移电子2 mol,则锰元素从+4变成+2价,溶液是显酸性,反应还有水生成,配平书写离子方程式;
③代入平衡常数表达式K=$\frac{{c}^{6}({H}^{+})}{{c}^{3}(F{e}^{3+})×c(N{{H}_{4}}^{+})×{c}^{2}(S{{O}_{4}}^{2-})}$计算.
解答 解:(1)①要把铜从铜盐中置换铜出来,比如用铁就可以,铁是作还原剂的,所以加入还原剂,故答案为:还原剂;
②根据图示信息,pH=8-9之间,反应速率为0,所以要使反应停止,调节溶液的pH至8-9 之间,故答案为:调节溶液的pH至8-9 之间;
(2)①加入的碳酸氢铵目的是调高pH,碳酸氢根离子能与溶液中氢离子反应,使溶液pH增大,故答案为:HCO3-;
②由题意可知,亚铁离子变成了铁离子,1mol MnO2转移电子2 mol,则锰元素从+4变成+2价,溶液是显酸性,反应还有水生成,反应离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
③除去杂质的化学方程式可表示为:3Fe3++NH4++2SO42-+6H2O=NH4Fe3 (SO4)2(OH)6+6H+,过滤后母液的pH=2.0,c(Fe3+)=a mol•L-1,c( NH4+)=b mol•L-1,c( SO42-)=d mol•L-1,氢离子浓度为10-2,代入平衡常数表达式K=$\frac{{c}^{6}({H}^{+})}{{c}^{3}(F{e}^{3+})×c(N{{H}_{4}}^{+})×{c}^{2}(S{{O}_{4}}^{2-})}$=$\frac{(1{0}^{-2})^{6}}{{a}^{3}×b×{d}^{2}}$=$\frac{1{0}^{-12}}{{a}^{3}b{d}^{2}}$,
故答案为:$\frac{1{0}^{-12}}{{a}^{3}b{d}^{2}}$.
点评 本题考查实验制备方案、化学工艺流程、对操作与试剂的分析评价、方程式书写、平衡常数计算、电镀等,侧重考查学生的分析能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1L溶液中所含阴阳离子总数是1.5NA个 | |
| B. | 1L溶液中含0.5NA个NO3- | |
| C. | 500 mL溶液中Ba2+的浓度是0.5 mol/L | |
| D. | 500mL溶液中含0.5NA个NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 75% | C. | 25% | D. | 66% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体 | |
| B. | 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的有机物,下列关于它的说法不正确的是( )
的有机物,下列关于它的说法不正确的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有8种 | ||
| C. | 能与溴水发生加成反应 | D. | 难溶于水,且密度比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液中滴加硫酸氢钠至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 饱和碳酸钠溶液中通入二氧化碳后溶液变浑浊:2Na++CO32-+CO2+H2O=2NaHCO3↓ | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 5.6g Fe与200mL2.0mol/L HNO3溶液充分反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族
| 选项 | a | b | c | d |
| X | 温度 | 加入氢气 | 加入丙 | 温度 |
| Y | n(丙) | 丙的转化率 | n(生成物) | n(H2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com