

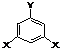
 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式 ,而桂皮酸的苯环上只有一个取代基,结合G的结构简式可知,桂皮酸的结构简式为
,而桂皮酸的苯环上只有一个取代基,结合G的结构简式可知,桂皮酸的结构简式为 .
.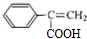 ,A与溴的四氯化碳溶液反应生成B,B发生水解反应反应生成C,C氧化生成D,D进一步氧化、酸化得到E,E在浓硫酸、加热条件下生成F,应是发生消去反应,由F的结构可知,A为
,A与溴的四氯化碳溶液反应生成B,B发生水解反应反应生成C,C氧化生成D,D进一步氧化、酸化得到E,E在浓硫酸、加热条件下生成F,应是发生消去反应,由F的结构可知,A为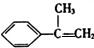 ,B为
,B为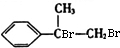 ,C为
,C为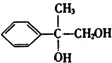 ,D为
,D为 ,E为
,E为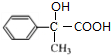 ,H为
,H为 ,据此解答.
,据此解答. ,而桂皮酸的苯环上只有一个取代基,结合G的结构简式可知,桂皮酸的结构简式为
,而桂皮酸的苯环上只有一个取代基,结合G的结构简式可知,桂皮酸的结构简式为 .
. ,A与溴的四氯化碳溶液反应生成B,B发生水解反应反应生成C,C氧化生成D,D进一步氧化、酸化得到E,E在浓硫酸、加热条件下生成F,应是发生消去反应,由F的结构可知,A为
,A与溴的四氯化碳溶液反应生成B,B发生水解反应反应生成C,C氧化生成D,D进一步氧化、酸化得到E,E在浓硫酸、加热条件下生成F,应是发生消去反应,由F的结构可知,A为 ,B为
,B为 ,C为
,C为 ,D为
,D为 ,E为
,E为 ,H为
,H为 ,
, ;分子中有6种化学环境不同的氢原子,故其核磁共振氢谱共有6个峰,
;分子中有6种化学环境不同的氢原子,故其核磁共振氢谱共有6个峰, ;6;
;6; ,含有羟基,可以发生取代反应,含有醛基可以发生氧化反应、还原反应,不能发生水解反应,故选:ABC;
,含有羟基,可以发生取代反应,含有醛基可以发生氧化反应、还原反应,不能发生水解反应,故选:ABC;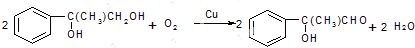 ,
,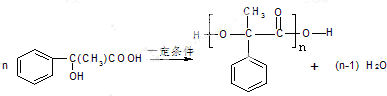 ,
,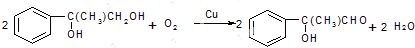 ;
; ;
; )的同分异构体甚多,其中有一类可用通式
)的同分异构体甚多,其中有一类可用通式 表示(其中X、Y均不为H),能发生银镜反应,符合条件的四种物质的结构简式为:
表示(其中X、Y均不为H),能发生银镜反应,符合条件的四种物质的结构简式为: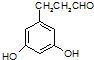 、
、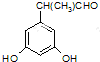 、
、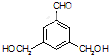 、
、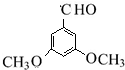 ,
, ;
; ;
; ;
; .
.


科目:高中化学 来源: 题型:
| A、常温常压下42g 乙烯和丁烯混合气体中,极性键数为6NA |
| B、100 mL 0.1 mol?L-1 Na2CO3溶液中,离子总数是0.03NA |
| C、标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 |
| D、6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
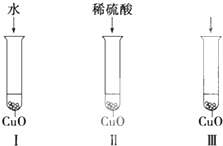 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
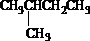
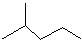
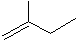
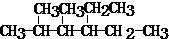
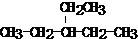
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
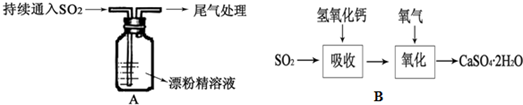
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol?L-1盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol?L-1硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol?L-1硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
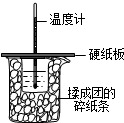 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com