
【题目】钛是一种性能非常优越的金属,它化学性质稳定,耐腐蚀、钛及钛合金主要用于飞机、火箭、导弹、人造卫星和宇宙飞船等领域,某实验室模拟硫酸法生产二氧化钛,实验流程如下:
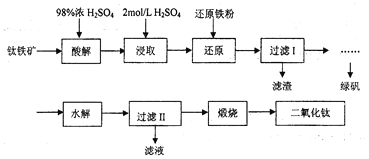
(1)酸解过程中发生的主要反应如下:FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O 请补充生成TiOSO4的化学方程式________________________________________;
(2)若取5g钛铁矿(主要成分是FeTiO3,含少量Fe2O3)于蒸发皿,加适量98%浓硫酸(密度1.84g/cm3)加热,请选择最接近的浓硫酸的用量_____________(填序号)。
A.2mL B.6mL C.25mL D.100mL
(3)在酸解后的浸取过程中,为提高浸出率可采用的方法有_____________。(任答一点)
(4)加“还原铁粉”的目的_____________。
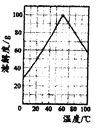
(5)请根据FeSO4溶解度曲线,补充由过虑I中滤液获得副产品绿矾(FeSO4·7H2O)的具体操作:取过滤I所得的滤液_______________________________________________________________。
(6)“水解”过程的操作步骤:将滤液加热至90℃,加6~7倍体积的溺水,保持沸腾60min,减压过滤,用2mol/LH2SO4溶液洗涤沉淀,请思考,“将滤液加热至90℃”作用是_____________________________。沉淀用2mol/LH2SO4溶液洗涤而不是用水洗涤的原因_____________________________。
【答案】
(1)FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
(2)B
(3)粉碎矿石、适量处长浸取时间等
(4)将溶液中的Fe3+还原成Fe2+
(5)加热浓缩到60℃饱和溶液,冷却至0℃结晶、过滤,少量冰水洗涤、低温干燥
(6)促进TiOSO4和Ti2(SO4)3的水解,防止Fe2+水解而造成产物不纯
【解析】
试题分析:(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,根据反应物和生成物书写方程式为FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;
(2)5gFeTiO3的物质的量为![]() ,98%浓硫酸物质的量浓度 为18.4mol/L,根据反应FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O,可计算出消耗浓硫酸的体积约为5.4mL,根据FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O,可计算出消耗浓硫酸的体积约为3.5mL,则最接近的浓硫酸的用量为6mL,答案为B。
,98%浓硫酸物质的量浓度 为18.4mol/L,根据反应FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O,可计算出消耗浓硫酸的体积约为5.4mL,根据FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O,可计算出消耗浓硫酸的体积约为3.5mL,则最接近的浓硫酸的用量为6mL,答案为B。
(3)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间外,还可以采用升高温度、增大反应物接触面积、搅拌等方法,即采用将熔块粉碎(或连续搅拌、适当升高温度等)方法;
(4)根据2Fe3++Fe=3Fe2+可知,加“还原铁粉”的目的是将溶液里的Fe3+还原为Fe2+;
(5)请根据FeSO4溶解度曲线,从过虑I中滤液获得副产品绿矾(FeSO4·7H2O)的具体操作为加热浓缩到60℃饱和溶液,冷却至0℃结晶、过滤,少量冰水洗涤、低温干燥;
(6)水解是吸热过程,将滤液加热至90℃作用是促进TiOSO4和Ti2(SO4)3的水解;沉淀用2mol/LH2SO4溶液洗涤而不是用水洗涤的原因防止Fe2+水解而造成产物不纯。


科目:高中化学 来源: 题型:
【题目】2015年10月5日,我国女药学家屠哟哟发现青蒿素(分子式为C15H22O5)治疗疟疾。而荣获2015年诺贝尔生理学医学奖。青蒿素的一种化学合成路线部分工艺流程(→……→表示省略了许多步骤)如下:
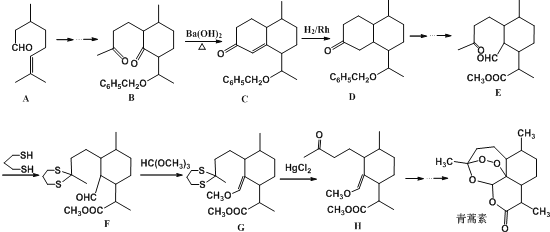
(1)1mol青蒿素完全燃烧消耗O2的物质的量为___________。
(2) A中含氧官能团的名称___________,该物质核磁共振氢谱中一共有___________个吸收峰,C→D的反应类型___________,B→C实际上是分两步反应进行的,先进行加成反应,再进行___________反应。
(3)写出丙酮![]() 与
与![]() 一定条件下反应的化学方程式___________;合成路线中设计由E→F与G→H的目的是___________;
一定条件下反应的化学方程式___________;合成路线中设计由E→F与G→H的目的是___________;
(4)任写一种同时满足以下条件的青蒿素的同分异构体的结构简式___________;
①能与FeC13溶液发生显色反应
②能与NaHCO3溶液反应
③lmol该物质与足量NaOH反应消耗4mo1NaOH
④该物质核磁共振氢谱中有6组吸收峰.且峰面积之比为1:1:2:2:4:12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)有机化合物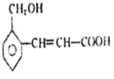 可能发生的化学反应有
可能发生的化学反应有
①加成 ②氧化 ③燃烧 ④加聚 ⑤取代
A.①②③ B.①②③④⑤ C.①②③④ D.①③④
(二)已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料。
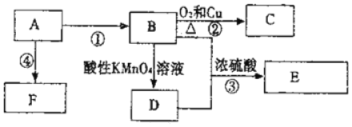
(1)A的结构简式为 。
(2)D分子中的官能团是 。
(3)写出下列反应的化学方程式。
② 。
④ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学课外兴趣小组学生在实验室里制取的乙烯中长混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题
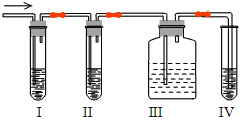
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是I ;Ⅱ ;Ⅲ ;Ⅳ 。依次填为( )
①品红溶液 ②NaOH溶液 ③浓硫酸 ④酸性KMnO4溶液
A.④②①③ B.①②①③ C.①②①④ D.④②①④
(2)能说明SO2气体存在的现象是____________。
(3)使用装置Ⅲ的目的是____________。
(4)确定含有乙烯的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ如图所示:已知甲、乙、丙常温下都为气体。
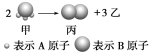
(1)乙气体的分子式 。(用A、B表示,A、B可以选择性使用)
(2)若测得生成物的混合气体对氢气的相对密度为d,则甲的摩尔质量为 。(用d表示)
(3)标准状况下,11.2L甲气体溶于500mL水中,所得溶液的密度为ρg/cm3,则所得溶液中甲的物质的量浓度为 (用d、ρ表示)(甲的摩尔质量用(2)中的数据)。
Ⅱ完成下列离子方程式。
(1)贝壳溶于醋酸溶液: 。
(2)向氢氧化钡溶液中加入少量小苏打溶液: 。
(3)碳酸氢铵和足量浓烧碱溶液混合: 。
(4)向次氯酸钠溶液中通足量SO2气体: 。
(5)向溴化亚铁溶液中通入足量氯气: 。
(6)向偏铝酸钠溶液中通入足量CO2气体: 。
(7)向硫酸亚铁溶液中加入酸性高锰酸钾溶液: 。
(8)金属锌和硫酸、三氧化二砷反应生成砷化氢: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面列出了几组物质,请将物质的合适组号填写在空格上。
同素异形体 , 同分异构体 。
①金刚石与“足球烯”( C60 ); ② D与T ; ③ 16O、17O和18O ;④ 氧气(O2)与臭氧(O3); ⑤ CH4和CH3CH2CH3 ; ⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑦![]() 和
和![]() ; ⑧尿素[CO(NH2)2]和 氰酸铵(NH4CNO)
; ⑧尿素[CO(NH2)2]和 氰酸铵(NH4CNO)
(2)H2O2、KCl、Na2SO4、Na2O2、NH3、O2中只含离子键的是 ,既有极性键又有非极性键的是 。既含离子键又含非极性键的物质的电子式是 ,请用电子式表示只含极性键的物质的形成过程: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如右图所示。图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是
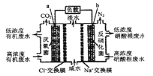
A.b电极为该电池的负极
B.b电极附近溶液的pH减小
C.a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+
D.中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、CO、CO2是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)如图所示,利用电化学原理将NO2 转化为重要化工原料C。
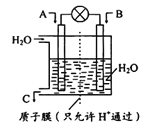
若A为NO2,B为O2,则负极的电极反应式为______________________________;
(2)有一种用CO2生产甲醇燃料的方法:
CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-b kJ·mol-1;
H2O(g)=H2O(l) △H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_________________________________;
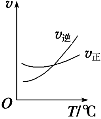
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g) ![]() COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
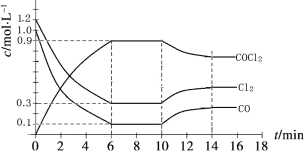
①0~6 min内,反应的平均速率v(Cl2)= ;
②若保持温度不变,在第7min 向体系中加入这三种物质各2mol,则平衡向____________________
移动(填“向正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.7mol/L、c(CO)=0.5mol/L、c(COCl2)_________ mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
④随温度升高,该反应平衡常数变化的趋势是__________;(填“增大”、“减小”或“不变”)
⑤比较第8min反应温度T(8)与第15min反应温度T(15)的高低:T(8)_______T(15)(填“<”、“>”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸:
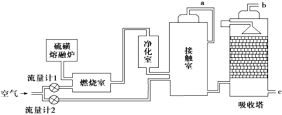
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是_____________________________________________。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为__________(空气中氧气的体积分数按0.2计),该尾气的处理方法是________。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面__________________________。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com