
 已知甲、乙、丙、X、Y为中学化学常见物质,其中甲、乙、丙中均含有元素A,其转化关系如图所示(反应条件已省略):
已知甲、乙、丙、X、Y为中学化学常见物质,其中甲、乙、丙中均含有元素A,其转化关系如图所示(反应条件已省略):
| ||
| ||
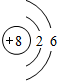 ,硫酸铜溶液中铜离子水解:Cu2++2H2O?Cu(OH)2+2H+,破坏水的电离平衡,溶液呈酸性,
,硫酸铜溶液中铜离子水解:Cu2++2H2O?Cu(OH)2+2H+,破坏水的电离平衡,溶液呈酸性,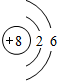 ;Cu2++2H2O?Cu(OH)2+2H+;
;Cu2++2H2O?Cu(OH)2+2H+;| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
235 95 |
235 92 |
| A、具有相同的原子序数 |
| B、具有相同的中子数 |
| C、具有相同的质量数 |
| D、具有相同的核外电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制备氢氧化铝,用铝盐和过量的氨水:Al3++3OH-=Al(OH)3↓ | ||||
| B、漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2=CaSO3↓+2HClO | ||||
C、铁粉和水蒸气反应:2Fe+3H2O(g)
| ||||
| D、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 )主要用于配置香辛樱桃、杏、蜂蜜等香料.
)主要用于配置香辛樱桃、杏、蜂蜜等香料.
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:
(1)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O→2HCO3- |
| B、FeSO4溶液在空气中变质:4Fe2++O2+2H2O→4Fe3++4OH- |
| C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| D、碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-→2CaCO3↓+Mg(OH)2↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )| A、该反应的还原剂是Cl- |
| B、消耗1mol还原剂,转移6mol电子 |
| C、氧化剂与还原剂的物质的量之比为2:3 |
| D、反应后溶液的酸性明显增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com