
(1)3.01×1022个OH- 的物质的量为________,质量为________,含有质子的物质的量为________,含有电子的物质的量为________。
(2)相同状况下,10mL X2气体与30mL Y2气体化合生成20mL C气体,则C的化学式为_________。
(3)某地酸雨经检验,除含氢离子外,还有如下离子:c(Na+)=1.4×10-3 mol·L-1 ,
c(Cl- ) =3.5×10-3 mol·L-1,c(NH4+) =2.3×10-3 mol·L-1, c(SO42-) =1.5×10-3
mol·L-1。则该溶液中氢离子的浓度为_________。
(1)0.05 mol,0.85 g,0.45 mol,0.5 mol。 。
(2)XY3 (3)2.8×10-3 mol·L-1
解析试题分析:(1)3.01×1022个OH- 的物质的量为:3.01×1022÷6.02×1023mol-1=0.05mol;质量为:0.05mol×17g/mol=0.85g;1个OH?含有9个质子,所以含有质子的物质的量为:0.05mol×9=0.45mol;1个OH?含10个电子,所以含电子的物质的量为::0.05mol×10=0.5mol。
(2)根据阿伏伽德罗定律,气体体积之比等于物质的量之比,所以该反应为:X2+3Y2=2C,再根据质量守恒定律,反应前后原子的种类和数目相等,C的化学式为XY3。
(3)因为溶液呈中性,阳离子所带正电荷总数等于阴离子所带负电荷总数,可得:1.4×10-3 mol·L-1 +2.3×10-3 mol·L-1 +c(H+)=3.5×10-3 mol·L-1 +2×1.5×10-3,c(H+)=2.8×10-3 mol·L-1。
考点:本题考查化学计算、阿伏伽德罗定律、质量守恒定律、电荷守恒。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(T)变化的曲线(已知草酸锰不稳定,但其中锰元素的化合价在300 ℃以下不变)。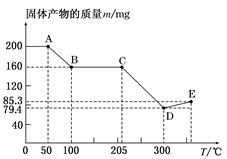
试回答下列问题:
(1)写出B点固体产物的化学式:_________________________________________。
(2)从B点到C点过程中固体物质质量不变的原因是_____________________________________________________。
(3)通过计算确定D点产物的相对分子质量,并推断其合理的化学式:____________
(4)从D点到E点过程中固体物质质量增加的原因是___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
天然碱的组成可以用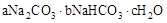 (a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
(a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
将质量为31.0 g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 2.24 L(标准状况)和水5.4 g。
(1)天然碱A的化学式中: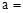
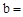

已知:Na2CO3与稀盐酸的反应分下列两步进行:
Na2CO3+HCl NaCl+NaHCO3 NaHCO3+HCl
NaCl+NaHCO3 NaHCO3+HCl NaCl+CO2↑+H2O
NaCl+CO2↑+H2O
将质量为12.45 g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐
酸的体积(标准状况)的关系如下表所示:
| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
CO、O2、CO2混合气体9mL电火花引爆后,恢复到原来状态时,气体体积减少1mL,通过NaOH溶液后,体积又减少5mL,则混合气体中CO、O2、CO2体积比可能为 ___ __ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定量的氢气在氯气中燃烧,所得混合物用100ml 3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
(1)所得溶液中Cl-的物质的量为 mol。
(2)参加反应的氢气在标准状况下的体积是 L。(写出计算过程,下同)
(3)所用氯气和参加反应的氢气的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此回答下列问题:
(1)该硫酸的物质的量浓度为 mol/L。
(2)配制250mL 0.92mol·L-1的稀硫酸需取该硫酸 mL。(2分)
(3)配制时必需的玻璃仪器有:______________________________________________________。(2分)
(4)定容时,待容量瓶中溶液的凹液面正好与刻度线相切,盖好瓶塞后的下一步操作是______。(1分)
(5)定容时,若加入的水超过刻度线,必须采取的措施是 。(1分)
(6)下列操作对H2SO4的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯: ;(1分)
②容量瓶用水洗净后未烘干: ;(1分)
③定容时俯视容量瓶的刻度线: 。(1分)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)①现有11g由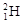 和
和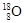 组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个。
组成的水分子的物质的量 mol,其中含中子数为 mol,电子数为 个。
②请画出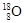 2-微粒的结构示意图: 。
2-微粒的结构示意图: 。
(2)质量相等的两种物质SO2和SO3,两种物质中硫元素质量之比为 ,分子物质的量之比为 ,所含氧原子个数之比为 。
(3)0.2L 0.5mol/L Al2(SO4)3溶液和0.5L 0.5mol/L Al2(SO4)3溶液所含SO42—离子浓度之比为____________,SO42—离子数目之比为____________。
(4)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为 ,则含R 8.0g 的NaR的物质的量为 mol 。
(5)实验室用二氧化锰与浓盐酸反应制取氯气,反应方程式如下:
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl 2在标准状况下的体积为 L。
MnCl2+2H2O+Cl2↑。若0.1 molMnO4与足量的浓盐酸充分反应,则有 mol HCl被氧化,转移电子的物质的量为 mol,产生的Cl 2在标准状况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为:
______ ______________
(2)写出苯发生硝化反应的化学方程式:
___________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com