
| A. | Y的阳离子半径比W的阴离子半径小 | |
| B. | 气态氢化物的稳定性:X<Z<W | |
| C. | X、Z、W的氧化物对应的水化物的酸性强弱:X<Z<W | |
| D. | 室温下,含Y元素的盐形成的水溶液的pH<7 |
分析 Y元素的单质既能与盐酸反应也能与NaOH溶液反应,应为Al元素,Z原子的最外层电子数是次外层电子数的一半,应为Si元素,X与Z位于同一主族,则X为C元素,Y、Z、W原子的最外层电子数之和为14,则W的最外层电子数为14-3-4=7,且原子序数最大,应为Cl元素,结合元素周期律的递变规律判断元素对应的单质、化合物的性质.
解答 解:由以上分析可知X为C、Y为Al、Z为Si,W为Cl,
A.Y为Al、W为Cl,的阳离子比W的阴离子少一个电子层,则Y的阳离子半径比W的阴离子半径小,故A正确;
B.非金属性Cl>C>Si,元素的非金属越强,对应的氢化物越稳定,故B错误;
C.非金属性Cl>C>Si,元素的非金属越强,对应的最高价氧化物的水化物的酸性越强,故C错误;
D.Y是铝元素,含铝元素的盐如AlCl3水溶液显酸性,NaAlO2水溶液显碱性,故D错误.
故选A.
点评 本题考查元素的推断及元素化合物的性质,题目难度中等,注意从物质的性质作为推断题的突破口,注意常见既能与盐酸反应也能与NaOH溶液反应的物质,题中从常见元素化合物的性质入手考查,是一道位置、结构、性质有机结合综合考查学生分析能力、推断能力的典型题目,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨水的物质的量浓度等于氢氧化钠溶液 | |
| B. | 将氨水体积稀释10倍,pH<11 | |
| C. | 等体积氨水和氢氧化钠溶液与足量氯化铁溶液反应,氨水产生的沉淀多 | |
| D. | 将等体积的氨水和氢氧化钠用稀盐酸完全中和,消耗盐酸的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:1:1 | B. | 1:1:2 | C. | 1:2:3 | D. | 2:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可以净水:Al3++3H2O=Al(OH)3(胶体)↓+3H+ | |
| B. | 少量小苏打溶液滴入Ba(OH)2溶液中:HCO-3+Ba2++OH-=BaCO3↓+H2O | |
| C. | 硫氢化钠发生水解:HS-+H2O?H3O++S2- | |
| D. | 氧化亚铁加入稀硝酸:FeO+2H+=Fe2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由2H和18O所组成的水22g,其中所含的中子数为11 NA | |
| B. | 分子数为NA的N2、CO混合气体体积为22.4 L,质量为28 g | |
| C. | 标准状况下,22.4LNO和11.2L O2混合后气体的原子总数为3NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取11.7 g CuO粉末 | |
| B. | 用100 mL量筒量取5.26 mL稀硫酸溶液 | |
| C. | 温度计上显示的室温读数为25.68℃ | |
| D. | 用广泛pH试纸测得溶液的pH为3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
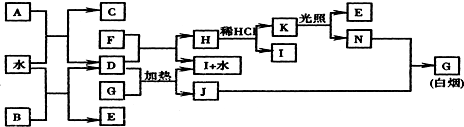
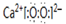 ;K的结构式是H-O-Cl.
;K的结构式是H-O-Cl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
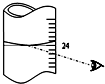 叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com