
分析 KHC8H4O4+NaOH=KNaC8H4O4+H2O,根据反应方程式,结合n=cV进行计算求解.
解答 解:邻苯二甲酸氢钾0.7159g物质的量=$\frac{0.7159g}{204.22g/mol}$=0.0035mol,依据方程式:KHC8H4O4+NaOH=KNaC8H4O4+H2O得:
KHC8H4O4+NaOH=KNaC8H4O4+H2O
1 1
0.0035mol C×0.03495L
则0.0035mol=C×0.03495L,解得C=1.0000mol/L;
答:Na0H溶液的浓度为1.0000mol/L;
点评 本题考查了有关物质的量的计算,准确写出反应方程式,找准物质之间的关系是解题关键,题目难度不大.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.18g | B. | 6.36g | C. | 4.22g | D. | 5.28g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2和 | B. | CH2═CH-CH2-CH3和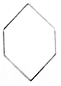 | ||
| C. | CH≡C-CH2-CH3和CH2═CH-CH═CH2 | D. | 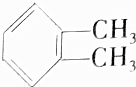 和 和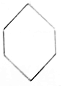 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
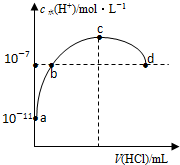
| A. | b、d两点为恰好完全反应点 | |
| B. | c点溶液中c(NH4+)=c(Cl-) | |
| C. | a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) | |
| D. | 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com