考点:晶胞的计算,共价键的形成及共价键的主要类型,晶体的类型与物质熔点、硬度、导电性等的关系,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:(1)熔点高低顺序为:原子晶体>离子晶体>金属晶体>分子晶体,分子晶体中,其熔点与相对分子质量成正比,原子晶体熔点高低与其原子半径成反比;分子晶体熔化时不需破坏化学键,原子晶体熔化时只需破坏共价键;
(2)同种非金属元素之间形成非极性键,不同非金属元素之间易形成极性键,分子中正负电荷重心重合的分子为非极性键分子,正负电荷重心不重合的分子为非极性分子;由离子构成的晶体为离子晶体,由分子构成的晶体为分子晶体,由原子构成的晶体属于原子晶体;
(3)①金刚石中每个碳原子和其余四个原子形成正四面体结构;
②NaCl属于离子晶体,其阴阳离子配位数是6;
③CsCl属于离子晶体,其阴阳离子配位数是8;
④干冰属于分子晶体,根据晶胞结构判断;
⑤石墨晶体中,每一层中每个C原子和相邻3个C原子相连,层和层之间存在分子间作用力.
解答:
解:(1)晶体熔点高低顺序是:原子晶体>离子晶体>金属晶体>分子晶体,分子晶体的熔点与其相对分子质量成正比,二氧化碳属于分子晶体、NaCl属于离子晶体、Na属于金属晶体、Si属于原子晶体、二硫化碳属于分子晶体、金刚石属于原子晶体,原子晶体的熔点与其原子半径成反比,所以它们的熔点从低到高顺序是 ①<⑤<③<②<④<⑥;
分子晶体熔化时不需破坏化学键,所以熔化时不需破坏化学键①⑤,原子晶体熔化时只需破坏共价键,熔化时只需破坏共价键的是④⑥;
故答案为:①<⑤<③<②<④<⑥;①⑤;④⑥;
(2)①H
2中只存在非极性键,属于非极性分子,为分子晶体;
②(NH
4)
2SO
4中存在离子键、极性键,为离子晶体;
③SiC中只存在极性键,为原子晶体;
④CO
2中只存在极性键,属于非极性分子,为分子晶体;
⑤HF中只存在极性键,属于极性分子,为分子晶体,还含有氢键,
所以由极性键形成的非极性分子有④,由非极性键形成的非极性分子有①,能形成分子晶体的物质是①④⑤,含有氢键的晶体的化学式是⑤,属于离子晶体的是②,属于原子晶体的是③;
故答案为:④;①;①④⑤;⑤;②;③;
(3)①金刚石中每个碳原子和其余四个原子形成正四面体结构,代表金刚石的是D,故答案为:D;4;
②NaCl属于离子晶体,其阴阳离子配位数是6,A代表氯化钠,每个Na
+周围与它最接近且距离相等的Na
+有12,故答案为:A;12;
③CsCl属于离子晶体,其阴阳离子配位数是8,代表CsCl的是C,根据图片知,每个Cs
+与8个Cl
-紧邻,故答案为:C;8;
④干冰属于分子晶体,代表干冰的是B,每个CO
2分子紧邻的CO
2分子个数=3×8×
=12,故答案为:B;12;
⑤石墨晶体中,每一层中每个C原子和相邻3个C原子相连,层和层之间存在分子间作用力,代表石墨的是E,属于混合晶体,故答案为:E;混合晶体.
点评:本题考查物质结构和性质,从晶胞的计算、熔点高低判断、晶体类型的判断方面考查,熟练掌握典型晶体结构,会根据物质构成微粒判断晶体类型,难点是配位数的计算,题目难度中等.




 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 有机物环丙叉环丙烷,由于其特殊的电导结构一直受到理论化学家的注意,其结构如图所示.有关它的说法中错误的是( )
有机物环丙叉环丙烷,由于其特殊的电导结构一直受到理论化学家的注意,其结构如图所示.有关它的说法中错误的是( )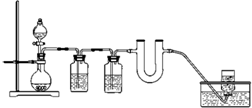 为证明Na2O2可作为潜水艇的供氧剂,某化学小组在实验室模拟CO2与Na2O2反应产生氧气的实验.
为证明Na2O2可作为潜水艇的供氧剂,某化学小组在实验室模拟CO2与Na2O2反应产生氧气的实验.