
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:不详 题型:单选题
| A.Cl-浓度不变 |
| B.溶液仍有浑浊 |
| C.溶液中几乎不存在Al3+ |
| D.溶液中存在最多的离子是Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8mol/L NaOH溶液 | B.2mol/L HNO3溶液 |
| C.3mol/L HC1溶液 | D.18mol/LH2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,铝能和空气里的氧气反应生成一层致密的氧化膜 |
| B.镁铝合金能完全溶于稀硝酸,同时生成无色气体,遇空气变成红棕色 |
| C.铝是较活泼的金属,能跟盐酸、稀硫酸、氢氧化钠溶液反应放出氢气 |
| D.在高温下,可以用铝制的容器装运浓硫酸或浓硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.参加反应的H2SO4为0.2mol | B.参加反应的NaOH约为0.27mol |
| C.加入铝粉的质量A=5.4 | D.与硫酸反应的铝粉的质量7.2g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.3:1 | C.3:2 | D.1:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
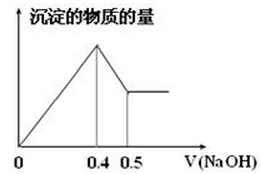
| A.1 :3 | B.2 :3 | C.6 :1 | D.3 :1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.200mL | B.250ml | C.425mL | D.560mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com