
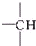 和
和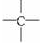 等结构组成的.如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含8个碳原子.
等结构组成的.如果某烷烃分子中同时存在这4种基团,所含碳原子数又最少,这种烃分子应含8个碳原子.  初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,可看到有氢气生成 | |
| B. | 将除去氧化膜的相同大小、相同质量的镁条和铝条与相同浓度NaOH溶液反应,前者速率大于后者 | |
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 大理石和盐酸反应制取CO2,增加大理石的用量可加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的相对分子质量为34g | |
| B. | CH4的摩尔质量为16 g | |
| C. | 1 mol SO42--的质量为96g | |
| D. | 标准状况下1 mol H2O 的体积是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
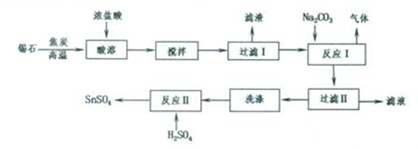
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 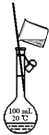 | 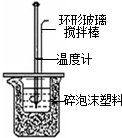 | 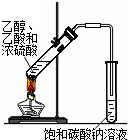 |
| A.实验室制取氨气 | B.配制100mL 0.1mol/L盐酸 | C.测定中和反应 的反应热 | D.实验室制备 乙酸乙酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MoS2煅烧产生的尾气可直接排到空气中 | |
| B. | MoO3不溶于氢氧化钠溶液 | |
| C. | H2MoO4是一种强酸 | |
| D. | 利用H2、CO和Al分别还原等量的MoO3,消耗还原剂的物质的量之比为3:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为7、中子数为8的氮原子:87N | |
| B. | 溴化铵的电子式: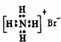 | |
| C. | 乙酸的比例模型: | |
| D. | 间硝基甲苯的结构简式: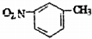 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com