
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ||||||
| 4 | ⑧ | ⑨ | ||||||
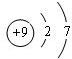 .
.分析 由元素在周期表中位置,知①为H、②为Li、③为C、④为N、⑤为F、⑥为Si、⑦为Cl、⑧为K、⑨为Br.
(1)同周期自左而右原子半径减小、同主族自上而下原子半径增大;
⑤为F,原子核外有9个电子层,有2个电子层,各层电子数为2、7;
(2)非金属性越强,对应氢化物越稳定;
(3)K与水反应生成氢氧化钾与氢气;
(4)氯气与KBr反应生成KCl与溴单质.
解答 解:由元素在周期表中位置,知①为H、②为Li、③为C、④为N、⑤为F、⑥为Si、⑦为Cl、⑧为K、⑨为Br.
(1)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故上述元素中K的原子半径最大,;
⑤为F,原子核外有9个电子层,有2个电子层,各层电子数为2、7,原子结构示意图为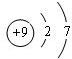 ,
,
故答案为:K;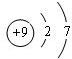 ;
;
(2)同周期自左而右非金属性增强,非金属性越强,对应氢化物越稳定,故CH4的稳定性最差,
故答案为:CH4;
(3)K与水反应生成氢氧化钾与氢气,反应方程式为:2K+2H2O═2KOH+H2↑,
故答案为:2K+2H2O═2KOH+H2↑;
(4)氯气与KBr反应生成KCl与溴单质,反应离子方程式为:Cl2+2Br-═Br2+2Cl-,
故答案为:Cl2+2Br-═Br2+2Cl-.
点评 本题考查元素周期表与元素周期律综合应用,难度不大,注意对元素周期律的理解掌握.


科目:高中化学 来源: 题型:选择题
 如图:烧瓶中充满a气体,滴管和烧杯中盛放足量b溶液,将滴管中溶液挤入烧瓶,打开止水夹f,能形成喷泉的是( )
如图:烧瓶中充满a气体,滴管和烧杯中盛放足量b溶液,将滴管中溶液挤入烧瓶,打开止水夹f,能形成喷泉的是( )| A. | a是Cl2,b是饱和NaCl溶液 | B. | a是NO,b是H2O | ||
| C. | a是CO2,b是饱和NaHCO3溶液 | D. | a是HCl,b是AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 3 mol•L-1氯酸钾溶液 | B. | 75 mL 3 mol•L-1氯化钙溶液 | ||
| C. | 150 mL 3 mol•L-1氯化钾溶液 | D. | 50 mL 3 mol•L-1氯化镁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1+△H2-△H3 | B. | 2△H1+△H2+△H3 | ||
| C. | △H1+0.5△H2+△H3 | D. | △H1+0.5△H2+0.5△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度为0.1 mol/L CH3COOH与0.1 mol/L CH3COONa混合后溶液呈弱酸性,则c(CH3COOH>c(Na+)>c(CH3COO-) | |
| B. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ | |
| C. | NaHCO3溶液:c(OH-)-c(H+)=c((HCO3-)+2c(H2CO3) | |
| D. | 等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②⑤⑥ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | [A-]=[K+] | B. | [H+]=[OH-]<[K+]<[A-] | C. | V总≥30mL | D. | V总≤30mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com