
分析 发生2SO2+O2?2SO3,2min末测得容器中有1.6mol SO2,则转化的SO2的物质的量为4mol-1.6mol=2.4mol,结合v=$\frac{△c}{△t}$计算.
解答 解:(1)2min末测得容器中有1.6mol SO2,则参加反应的二氧化硫物质的量为4mol-1.6mol=2.4mol,由2SO2+O2?2SO3可知生成的三氧化硫的物质的量为2.4mol,故SO3的浓度为$\frac{2.4mol}{2L}$=1.2mol/L,
答:2min末SO3的浓度为1.2mol/L;
(2)v(SO2)=$\frac{\frac{2.4mol}{2L}}{2min}$=0.6 mol/(L.min),
答:2min内SO2的平均反应速率为0.6 mol/(L.min).
点评 本题考查化学平衡的计算,为高频考点,把握发生的反应、各物质的量的关系等为解答的关键,侧重分析与计算能力的考查,注意速率的计算公式应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
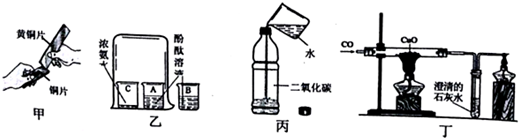
| A. | 甲实验中黄铜片能在铜片上刻画出痕迹可以说明黄铜的硬度比铜片大 | |
| B. | 乙实验既可以说明分子在不停的运动着,又可以说明氨水显碱性 | |
| C. | 丙实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性 | |
| D. | 丁实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
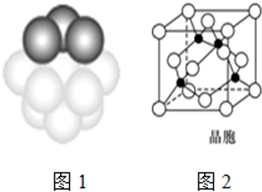
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素 | |
| C. | 除氦外的稀有气体原子的最外层电子数都是8 | |
| D. | 同一元素的各种同位素的物理性质、化学性质均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
序号 | 时间/min 物质的量/mol 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
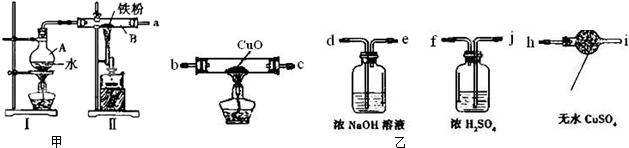
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com