
下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀硝酸,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | 铝箔插入稀硝酸中 | 无现象 | 铝箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
科目:高中化学 来源: 题型:选择题
| A. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| B. | 利用太阳能、潮汐能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源 | |
| D. | 大量排放SO2或CO2都会导致酸雨的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:实验题
Ⅰ、工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产过程中会产生沉淀氢氧化铁,用来制取FeCO3的流程如下:
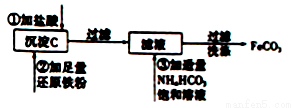
完成上述转化过程中的离子方程式
①____________________________。
②____________________________。
Ⅱ、有一瓶澄清溶液,其中可能含有可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-。取该溶液进行以下实验:
(1)填写表中开空白:
实验步骤 | 肯定不存在的离子 |
①用PH试纸检验,溶液呈强酸性 | |
②取出部分溶液,加入少量CCl4和数滴新制氯水,振荡,精置CCl4层呈紫红色 | |
③另取出部分溶液,向其加入NaOH溶液,使溶液从酸性变为碱性,在滴加过程中及滴加完毕后,均无沉淀产生 | |
④取③中的部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝 | |
⑤另取③中的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成 |
(2)根据以上事实,该溶液中肯定存在的离子是_________________。
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
下列有关NH4Fe(SO4)2水溶液的叙述正确的是
A.该溶液中Mg2+、H+、NO3-、Cl-可以大量共存
B.该溶液能使碘化钾试纸变蓝,反应的离子方程式为:Fe3++2I-=Fe2++I2
C.该溶液和足量的Ba(OH)2溶液反应的离子方程式为: Fe3++SO42-+Ba2++3OH-=BaSO4↓+Fe(OH)3↓
D. 该溶液与足量铜粉 反应的离子方程式为:2Fe3++3Cu=2Fe+3Cu2+
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
向碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6).下列有关该反应的说法中错误的是
A.在该反应中碘酸钠作还原剂
B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性
C.反应中生成1 mol Na2H3IO6转移2 mol电子
D.反应中氧化产物与还原产物的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
下列叙述正确的是(NA为阿伏加德罗常数的值)
A.7.8gNa2O2含有的共价键数为0.2NA
B.7.8gNa2S与Na2O2的混合物,含离子总数为0.3NA
C.标准状况下,22.4L溴单质含有NA个溴分子
D.0.2 molNa被完全氧化生成7.8gNa2O2,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源:2017届山西大学附中高三上10月模块诊断化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.氢氧化亚铁溶于稀硝酸:Fe(OH) 2+2H+=Fe2++2H2O
2+2H+=Fe2++2H2O
B.NH4Al(SO4)2溶液与 过量NaOH溶液反应:Al3++4OH-=AlO2-+2H2O
过量NaOH溶液反应:Al3++4OH-=AlO2-+2H2O
C.Na2SiO3溶液与稀盐酸混合:Na2SiO3+2H+=2Na++H2SiO3↓
D.Ca(HCO3)2溶液和Ca(OH)2溶液混合:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省琼海市高一上学期第一次月考化学试卷 题型:选择题
对下列未知盐的稀溶液所含离子的检验中,作出判断一定正确的是
A.加入硝酸银溶液,有白色沉淀生成,可判定含有Cl-
B.先加入足量稀盐酸,无沉淀生成,再加BaCl2溶液,产生白色沉淀,可判定含有SO42-
C.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+
D.加入盐酸后有无色无味气体逸出,此气体能使澄清石灰水变浑浊,可判定含有HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com