
| A. | 若a<b,则c<$\frac{1}{2}$(a+b) | B. | 若a<b,则c>$\frac{1}{2}$(a+b) | C. | 若a>b,则c=$\frac{1}{2}$(a+b) | D. | 若a=b,则c=$\frac{1}{2}$(a+b) |
分析 首先发生反应:2Na2O2+2CO2=2Na2CO3+O2,生成氧气体积为0.5a L,与bL NO混合又发生反应:O2+2NO=2NO2,二者恰好反应时0.5aL:b=1:2,则a=b,据此进行讨论计算解答.
解答 解:首先发生反应:2Na2O2+2CO2=2Na2CO3+O2,可知生成氧气体积为0.5a L,与bL NO混合又发生反应:O2+2NO=2NO2,
二者恰好反应时0.5aL:b=1:2,则a=b,此时生成NO2体积c=2×0.5a=b=$\frac{1}{2}$(a+b);
若a<b,则NO有剩余,由O2+2NO=2NO2,可知气体体积减少0.5aL,故得到气体体积等于NO的体积,则c=b,则c>$\frac{1}{2}$(a+b);
若a>b,则O2有剩余,由O2+2NO=2NO2,可知气体体积减少为参加反应氧气的体积,即气体体积减少为0.5b L,故得到气体体积为(0.5a L+b L-0.5b L)=$\frac{1}{2}$(a+b),
综上分析可知,A错误,BCD正确,
故选:A.
点评 本题考查混合物计算,属于讨论型题目,关键是判断恰好反应时量,以此讨论过量问题进行计算,较好地考查学生分析计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
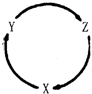 下表各组物质中,满足右图物质一步转化关系的选项是( )
下表各组物质中,满足右图物质一步转化关系的选项是( )| 选项 | X | Y | Z |
| A | Na | NaOH | NaHCO3 |
| B | Al | AlCl3 | Al(OH)3 |
| C | C | CO | CO2 |
| D | Si | SiO2 | H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是良好的半导体材料,且是制造光缆的主要材料 | |
| B. | SiO2不溶于水,也不溶于任何酸 | |
| C. | 可以用焦炭还原二氧化硅生产硅:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| D. | 硅胶可用作催化剂的载体和袋装食品的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①③④ | C. | ②③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X 的简单气态氢化物的热稳定性比W 的强 | |
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 | |
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 | |
| D. | 元素X 的简单气态氢化物的沸点比W的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常见的周期表中,共有七个周期,三个短周期、四个长周期 | |
| B. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| C. | 短周期元素,是指一、二、三周期,分别有2、8、8种元素 | |
| D. | ⅠA中的金属元素,称为碱金属元素,ⅦA元素又称为卤族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4mL | B. | 10.8mL | C. | 1.2mL或4mL | D. | 8mL或10.8mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
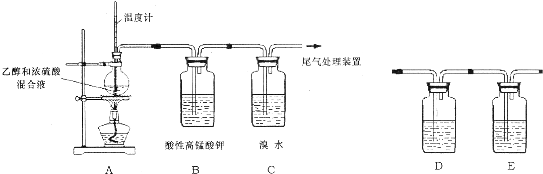
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com