
 E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.分析 E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,s能级最多排列2个电子,则n=2,所以M价层电子排布式为2s22p4,故M为O元素;E与M原子核外的未成对电子数相等,则E是C元素,G为N元素;QO2与NO2-为等电子体,则Q为S元素;T为过渡元素,其原子核外没有未成对电子,则T为Zn元素.
(1)与T同区、同周期元素为Cu元素,其原子核外有29个电子,3d、4s能级电子为其价电子,根据构造原理书写该原子价电子排布式;
(2)C、N、O均可与氢元素形成氢化物,它们的最简单氢化物在固态时都形成分子晶体,干冰和甲烷晶胞都是面心立方晶胞结构;
(3)C、N、O的最简单氢化物中,其氢化物空间构型分别是正四面体、三角锥形、V形,其键角依次减小;其中N的最简单氢化物的VSEPR模型名称为四面体,O的最简单氢化物的分子立体构型名称为V形;
(4)CO、NO+、N2互为等电子体,等电子体结构相似;
CO分子的极性极弱,形成配位键的共用电子对由氧原子提供,抵消共用电子对偏向氧产生的极性;
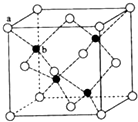
(5)ZnS晶体结构如图所示,该晶胞中黑色球个数是4、白色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为$\frac{4M}{{N}_{A}}$g,根据V=$\frac{m}{ρ}$计算晶胞体积,再计算晶胞棱长,ab之间距离为该晶胞体对角线长的$\frac{1}{4}$.
解答 解:E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为nsnnp2n,s能级最多排列2个电子,则n=2,所以M价层电子排布式为2s22p4,故M为O元素;E与M原子核外的未成对电子数相等,则E是C元素,G为N元素;QO2与NO2-为等电子体,则Q为S元素;T为过渡元素,其原子核外没有未成对电子,则T为Zn元素.
(1)与T同区、同周期元素为Cu元素,其原子核外有29个电子,3d、4s能级电子为其价电子,根据构造原理书写该原子价电子排布式为3d104s1,故答案为:3d104s1;
(2)C、N、O均可与氢元素形成氢化物,它们的最简单氢化物在固态时都形成分子晶体,干冰和甲烷晶胞都是面心立方晶胞结构,氨气、水分子之间存在氢键,则与干冰晶胞结构不同的是NH3、H2O,故答案为:NH3、H2O;
(3)C、N、O的最简单氢化物中,其氢化物空间构型分别是正四面体、三角锥形、V形,其键角依次减小,即键角大小顺序是CH4>NH3>H2O;其中N的最简单氢化物中N原子价层电子对个数是4,则氨气分子的VSEPR模型名称为四面体,O的最简单氢化物是水,水分子中O原子价层电子对个数是4且含有一个孤电子对,所以水分子立体构型名称为V形,
故答案为:CH4>NH3>H2O;四面体;V形;
(4)CO、NO+、N2互为等电子体,等电子体结构相似,则CO分子结构式为 ;
;
C、O电负性相差1.0,由此可以判断CO应该为极性较强的分子,但实际上CO分子的极性极弱,从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性,
故答案为: ;从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性;
;从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性;
(5)ZnS晶体结构如图所示,该晶胞中黑色球个数是4、白色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为$\frac{4M}{{N}_{A}}$g,则晶胞V=$\frac{4M}{{N}_{A}}$g÷ρg/cm3=$\frac{4M}{ρ{N}_{A}}$cm3,则晶胞棱长=$\root{3}{\frac{4M}{ρ{N}_{A}}}$cm,
ab之间距离为该晶胞体对角线长的$\frac{1}{4}$,故ab之间距离=$\frac{1}{4}$×$\sqrt{3}$×=$\root{3}{\frac{4M}{ρ{N}_{A}}}$cm=$\frac{\sqrt{3}}{4}×\root{3}{\frac{4M}{ρ{N}_{A}}}$cm,
故答案为:$\frac{\sqrt{3}}{4}×\root{3}{\frac{4M}{ρ{N}_{A}}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、原子杂化方式判断、分子空间构型判断、原子核外电子排布等知识点,难点是晶胞计算中ab距离与晶胞体对角线长关系,需要学生具备一定的空间想象与数学计算能力,题目难度中等.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | 反应容器中密度不随时间变化而变化 | |
| C. | 混合气体颜色深浅保持不变 | |
| D. | NO2、NO、O2的物质的量浓度之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验过程中水的电离程度的变化是先增大后减小 | |
| B. | 当溶液呈中性时,反应恰好完全 | |
| C. | 当反应恰好完全时,消耗NaOH溶液10mL | |
| D. | 当溶液呈碱性时,其中离子浓度由大到小的顺序可能为c(Na+)>c(OH-)>c(Ac-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA | |
| B. | 11.2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| C. | 300ml2mol•L-1蔗糖溶液中所含分子数为0.6NA | |
| D. | 标准状况下,30g乙酸和甲醛的混合物中氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
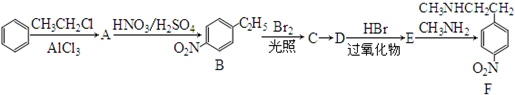
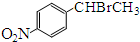 .
.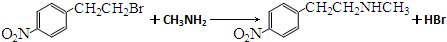 .
.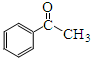 )常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线
)常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线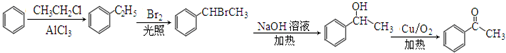 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
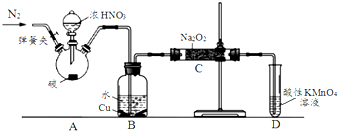
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{22.4}$摩/升 | B. | $\frac{ab}{22400}$摩/升 | ||
| C. | $\frac{ab}{22400+36.5a}$摩/升 | D. | $\frac{1000ab}{22400+36.5a}$摩/升 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中. $\stackrel{室温}{→}$
$\stackrel{室温}{→}$ ,反应类型为加成;该反应的产物除
,反应类型为加成;该反应的产物除 外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式
外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式 ;
; )是双环戊二烯的一种同分异构体,它的一氯代物有4种.
)是双环戊二烯的一种同分异构体,它的一氯代物有4种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com