
烯烃A在一定条件下可以按下面的框图进行反应.

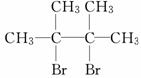 |
已知:D是 .
请填空:
(1)A的结构简式是:____________, C的结构简式是____________
(2)框图中属于取代反应的是:________(填数字代号).
(3)写出由D→E的化学方程式__________________________________________;
(4)写出由E→F的化学方程式__________________________________ _.
科目:高中化学 来源: 题型:
物质的结构决定性质,性质反映其结构特点。
(1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C;
c.晶体的熔点:金刚石< 石墨
d.晶体中共价键的键角:金刚石>石墨
 (2)某石蕊的分子结构如右图所示。
(2)某石蕊的分子结构如右图所示。
①石蕊分子所含元素中,基态原子2p轨道有两个成单电子的是 (填元素符号); 由其中两种元素形成的三角锥构型的一价阳离子是 (填化学式);
②该石蕊易溶解于水,分析可能的原因是 ;
(3)铜及其合金是人类最早使用的金属材料。
①NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2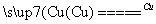 NF3+3NH4F
NF3+3NH4F
 上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。
上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②金属铜采取如图所示堆积方式,可称为_____堆积,则Cu晶体中
Cu原子的配位数为
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:

图95
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加____________,该过程的现象为________________________。
(2)步骤②加入过量H2O2的目的是________________________________________________________________________
________________________________________________________________________。
(3)步骤③中反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、________________________________________________________________________、
灼烧、________、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
可以用来鉴别己烯、甲苯、乙酸乙酯、苯酚溶液的一组试剂是
A.氯化铁溶液、溴水 B.碳酸钠溶液、溴水
C.溴水、酸性高锰酸钾溶液 D.酸性高锰酸钾溶液、氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
A.A、B简单离子半径大小关系为B3+>A2+
B.D、E形成的简单离子的还原性:E->D-
C.气态氢化物的稳定性:HD<H2C
D.最高价氧化物对应的水化物的酸性:H2CO4>HEO4
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是从元素周期表中截取的一个片断,其中X、Y、Z、W均属于短周期元素。请回答下列问题。

(1)若X单质为空气中的主要成分之一,则W的原子结构示意图为________。
(2)若Y、W、Z的最高价氧化物对应的水化物依次为一元酸、二元酸、三元酸,这三种酸的正盐的含氧酸根离子中,有两种的电子数相等,这两种离子的离子符号是________、________。
(3)若Na与Y和Z的单质分别反应可以生成摩尔质量相同的两种化合物,其中Na与Y形成的化合物的电子式为________,所含化学键的类型为________。
(4)Y元素在元素周期表中处于第________纵行(写出所有可能纵行数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
Ⅰ.打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体,其化学式为______________;铁粉与水蒸气在高温下也可生成该黑色固体,反应的化学方程式为________________________________________________________________________。
Ⅱ.某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如图94所示。

图94
请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是________________。
(2)步骤②中,除发生反应Fe+2HCl===FeCl2+H2↑外,其他可能反应的离子方程式为________________________________。
(3)溶液C的颜色是__________,溶液D中可能含有的金属阳离子有____________________。
(4)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是__________。
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,先产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
A.①② B.②③
C.③④ D.①④
(5)步骤⑤产生金属铜的化学方程式为________________________________________________________________________
________________________________________________________________________。
Ⅲ.金属的腐蚀所导致的钢铁损耗占钢铁年产量的1/4还多。在钢铁的吸氧腐蚀过程中,正极反应式为________________________________________________________________________,
若此过程中共生成了8 g Fe2O3,则转移的电子的物质的量为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)等质量的D216O和H216O所含的质子数之比为______,中子数之比为______;等物质的量的D216O和H216O分别与足量的金属钠反应,放出的氢气的质量比为_____,转移电子数之比为______。
(2)在2L密闭容器中进行如下反应: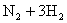
 ,5min内NH3的质量增加了1.7g,则v(NH3)= 。
,5min内NH3的质量增加了1.7g,则v(NH3)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com